Obiltoxaximab (NYXTHRACIS®)
Ancien nom commercial : Obiltoxaximab SFL® ,
Autre nom commercial : Anthim®
Structure : Anticorps chimérique de type IgG1 kappa
Code ATC : J06BB22
Nomenclature Ge : IgG1κ G1e0
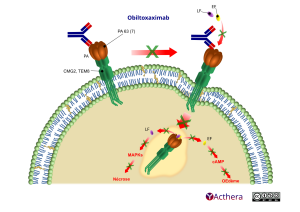
Cible: Antigène protecteur (PA) de Bacillus anthracis
Mode de production : produit par la technologie de l’ADN recombinant sur lignée cellulaire GS-NS0 de myélome murin
Forme galénique : Flacon de 6 mL contenant 600 mg d’obiltoxaximab (solution à 100mg/ml à diluer pour perfusion).
Mode d'administration : IV
Date de la première AMM : EMA novembre 2020 / FDA mars 2016
Laboratoires et lien vers xxx: SFL Pharmaceuticals Deutschland GmbH
Indications :
- indiqué en association avec des antibiotiques appropriés quel que soit l’âge pour le traitement de la maladie du charbon due à l’inhalation de Bacillus anthracis
- indiqué quel que soit l’âge en prophylaxie post-exposition de la maladie du charbon inhalé lorsque des alternatives thérapeutiques sont jugées inappropriées ou ne sont pas disponibles
Prix indicatif (année) : XXX
Posologies :
La dose recommandée d’NYXTHRACIS chez les patients adultes pesant au moins 40 kg est de 16 mg/kg de poids corporel, administrée en une perfusion intraveineuse unique. La dose recommandée d’NYXTHRACIS chez les patients adultes pesant moins de 40 kg est de 24 mg/kg, administrée en une perfusion intraveineuse unique
Mécanisme d'action :
Obiltoxaximab se lie à l’antigène protecteur (PA) de Bacillus anthracis, il inhibe alors la liaison du PA à ses récepteurs cellulaires, empêchant la pénétration dans la cellule du ‘facteur létal’ et du ‘facteur oedématogène’ de B. anthracis, les composants enzymatiques des toxines responsables de la maladie du charbon
Effets indésirables les plus fréquents : céphalées (4 %, 9/250), le prurit (4 %, 9/250) et l’urticaire (2 %, 6/250) (se référer au RCP pour avoir la liste complète des effets indésirables)
Contre-indications : Hypersensibilité à la substance active ou à l’un des excipients
Principales références :
- Greig SL. Obiltoxaximab: First Global Approval. Drugs. 2016 May;76(7):823-30. doi: 10.1007/s40265-016-0577-0. PMID: 27085536.
- Nagy CF, Leach TS, Hoffman JH, Czech A, Carpenter SE, Guttendorf R. Pharmacokinetics and Tolerability of Obiltoxaximab: A Report of 5 Healthy Volunteer Studies. Clin Ther. 2016 Sep;38(9):2083-2097.e7. doi: 10.1016/j.clinthera.2016.07.170. Epub 2016 Aug 24. PMID: 27568215.
- Nagy CF, Leach TS, King A, Guttendorf R. Safety, Pharmacokinetics, and Immunogenicity of Obiltoxaximab After Intramuscular Administration to Healthy Humans. Clin Pharmacol Drug Dev. 2018 Aug;7(6):652-660. doi: 10.1002/cpdd.410. Epub 2017 Nov 10. PMID: 29125719; PMCID: PMC6668011.
- Prince AS. The host response to anthrax lethal toxin: unexpected observations. J Clin Invest. 2003 Sep;112(5):656-8. doi: 10.1172/JCI19581. PMID: 12952914; PMCID: PMC182215.
Liens :
- Human medicine European public assessment report (EPAR)
- HAS (pas disponible au 19 janvier 2023)
- Base de données publique des médicaments (pas disponible au 19 janvier 2023)
- ANSM (pas disponible au 19 janvier 2023)
- Meddispar (pas disponible au 19 janvier 2023)
- Centre de référence sur les agents tératogènes (CRAT) (pas disponible au 19 janvier 2023)
Remarque :
Dernière mise à jour : 19 janvier 2023
Relecture par : Pr C. Carnoy