Tralokinumab (ADTRALZA®)
Autres noms : tralokinumab-idrm ; ADBRY®
Structure :AcM humain type IgG4 lambda
Code ATC : D11AH07
Nomenclature Ge : IgG4λ G4e0
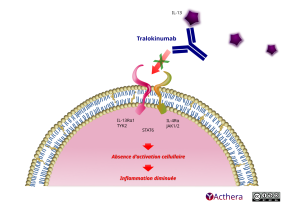
Cible: IL-13
Mode de production : Le tralokinumab est produit dans des cellules de myélome de souris grâce à la technologie de l’ADN recombinant
Forme galénique :
Seringue préremplie contenant 150 mg de tralokinumab
Stylo prérempli contenant 300 mg de tralokinumab
Mode d'administration : SC
Conservation : Ce médicament doit être conservé au réfrigérateur (entre 2 et 8°C) – avec en cas de besoin la possibilité d’une conservation à température ambiante (25 °C maximum) pendant 14 jours. Ne pas secouer les seringues avant injection.
Date de la première AMM : FDA Décembre 2021 / EMA juin 2021
Laboratoires : LEO Pharma A/S a racheté les droits du tralokinumab à Astrazeneca en 2016
Indications :
Ce médicament est indiqué dans le traitement de la dermatite atopique modérée à sévère de l’adulte et de l'enfant de plus de 12 ans, qui nécessite un traitement systémique, en cas d’échec, d’intolérance ou de contre-indication à la ciclosporine. Adtralza* peut être associé aux dermocorticoïdes, ainsi qu’aux inhibiteurs de la calcineurine topiques.
Prix indicatif (avril 2024) : 743,64 euros pour 300 mg.
Usage : Depuis septembre 2022, ADTRALZA* est disponible à l'officine. Ce produit est soumis à prescription hospitalière annuelle. La prescription initiale et le renouvellement sont réservés aux spécialistes en allergologie, en dermatologie, en médecine interne ou en pédiatrie.
Posologies :
La dose recommandée de tralokinumab pour les patients adultes et enfants de plus de 12 ans est une dose initiale de 600 mg (quatre injections de 150 mg ou deux de 300 mg), suivie de 300 mg (deux injections de 150 mg ou une seule de 300 mg) administrés toutes les 2 semaines par injection sous-cutanée.
Il est possible d’envisager chez les patients ayant obtenu une peau blanchie ou quasi blanchie après 16 semaines de traitement d’espacer les injections de 4 semaines.
Mécanisme d'action :
Le tralokinumab se lie de manière spécifique à la cytokine de type 2 interleukine-13 (IL-13) et inhibe son interaction avec les récepteurs de l’IL-13. Le tralokinumab neutralise l’activité biologique des IL-13 en bloquant leur interaction avec le complexe de récepteurs IL-13Rα1/IL-4Rα. L'IL-13 est un facteur majeur des pathologies inflammatoires humaines de type 2, comme la dermatite atopique, et l'inhibition de la voie de l'IL-13 par le tralokinumab diminue la présence de nombreux médiateurs de l'inflammation de type 2 chez les patients. Il est à noter qu'il existe un second récepteur à l'IL-13 (IL-13Rα2). Cependant ce récepteur ne permet pas la signalisation intracellulaire et est considéré comme un leurre pour capter l'IL-13.
Effets indésirables les plus fréquents : Peu nombreux et généralement d’intensité légère à modérée et non-graves. Il s’agit essentiellement de réactions au site d’injection, d’une rhinite virale (type rhume) et de conjonctivites. Signalons de rares cas d’hyperéosinophilie et d’eczéma herpétiforme. Pour la liste complète et exhaustive des effets indésirables, se référer au RCP.
Contre-indications : Hypersensibilité à la substance active ou à l’un des excipients. Eviter l'administration de vaccins vivants atténués pendant le traitement.
Principales références :
- Duggan S. Tralokinumab: First Approval. Drugs. 2021 Sep;81(14):1657-1663. doi: 10.1007/s40265-021-01583-1. Erratum in: Drugs. 2021 Sep 17;: Erratum in: Drugs. 2021 Sep 24;: PMID: 34406631; PMCID: PMC8519819.
- Wollenberg A, Blauvelt A, Guttman-Yassky E, Worm M, Lynde C, Lacour JP, Spelman L, Katoh N, Saeki H, Poulin Y, Lesiak A, Kircik L, Cho SH, Herranz P, Cork MJ, Peris K, Steffensen LA, Bang B, Kuznetsova A, Jensen TN, Østerdal ML, Simpson EL; ECZTRA 1 and ECZTRA 2 study investigators. Tralokinumab for moderate-to-severe atopic dermatitis: results from two 52-week, randomized, double-blind, multicentre, placebo-controlled phase III trials (ECZTRA 1 and ECZTRA 2). Br J Dermatol. 2021 Mar;184(3):437-449. doi: 10.1111/bjd.19574. Epub 2020 Dec 30. PMID: 33000465; PMCID: PMC7986411.
- Wollenberg A, Howell MD, Guttman-Yassky E, Silverberg JI, Kell C, Ranade K, Moate R, van der Merwe R. Treatment of atopic dermatitis with tralokinumab, an anti-IL-13 mAb. J Allergy Clin Immunol. 2019 Jan;143(1):135-141. doi: 10.1016/j.jaci.2018.05.029. Epub 2018 Jun 12. PMID: 29906525.
- Silverberg JI, Toth D, Bieber T, Alexis AF, Elewski BE, Pink AE, Hijnen D, Jensen TN, Bang B, Olsen CK, Kurbasic A, Weidinger S; ECZTRA 3 study investigators. Tralokinumab plus topical corticosteroids for the treatment of moderate-to-severe atopic dermatitis: results from the double-blind, randomized, multicentre, placebo-controlled phase III ECZTRA 3 trial. Br J Dermatol. 2021 Mar;184(3):450-463. doi: 10.1111/bjd.19573. Epub 2021 Feb 22. PMID: 33000503; PMCID: PMC7986183.
- Apter AJ. The tralokinumab story: Nothing is ever simple. J Allergy Clin Immunol. 2019 Apr;143(4):1336-1338. doi: 10.1016/j.jaci.2018.12.1005. Epub 2019 Jan 16. PMID: 30659852.
Liens :
- Human medicine European public assessment report (EPAR)
- HAS
- Base de données publique des médicaments
- Vidal
- ANSM
- Centre de référence sur les agents tératogènes (CRAT)
- Article du quotidien des pharmaciens sur la disponibilité à l'officine (septembre 2022).
- Article du Vidal : mise à disposition du stylo et d'un nouveau dosage.
Remarque :
Dernière mise à jour : 04/24
Relecture par : Mathilde GLAZIOU