Casirivimab imdevimab (RONAPREVE®)
Structure : 2 AcM humains (casirivimab (IgG1κ) et imdevimab (IgG1λ)), non modifiés au niveau des régions Fc
Code ATC : J06BD
Nomenclature Ge : IgG1κ G1e0
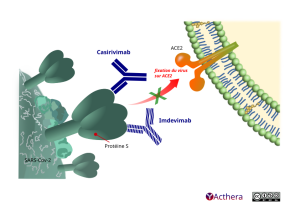
Cible : domaine RBD (receptor binding domain) de la glycoprotéine S du SARS-CoV-2
Mode de production : Produits à partir de cellules d’ovaire de hamster chinois (CHO) par la technique de l’ADN recombinant
Forme galénique : Chaque flacon de casirivimab contient 300 mg de casirivimab dans 2,5 mL (120 mg/mL). Chaque flacon d’imdevimab contient 300 mg d’imdevimab dans 2,5 mL (120 mg/mL).
Mode d'administration : IV ou SC
Date de la première AMM : FDA novembre 2020 / EMA novembre 2021
Laboratoires et lien vers RONAPREVE® : Roche
Indications : Covid-19
- Le traitement de la COVID-19 chez les adultes et adolescents âgés de 12 ans et plus pesant au moins 40 kg, ne nécessitant pas d’oxygénothérapie et présentant un risque accru d'évolution vers une forme sévère de la COVID-19
- La prévention de la COVID-19 chez les adultes et adolescents âgés de 12 ans et plus, pesant au moins 40 kg.
Prix indicatif (année) : XXX
Usage : xxx
Posologies :
- Traitement : La dose chez les patients adultes et les patients adolescents âgés de 12 ans et plus et pesant au moins 40 kg est de 600 mg de casirivimab et 600 mg d'imdevimab administrés en une seule perfusion intraveineuse ou par injection sous-cutanée. Le casirivimab et l'imdevimab doivent être administrés dans les 7 jours suivant l'apparition des symptômes de COVID-19.
- Prévention :
- Prophylaxie post-exposition : La dose chez les patients adultes et les patients adolescents âgés de 12 ans et plus et pesant au moins 40 kg est de 600 mg de casirivimab et 600 mg d'imdevimab administrés en une seule perfusion intraveineuse ou par injection sous-cutanée. Le casirivimab et l'imdevimab doivent être administrés dès que possible après contact avec un cas de COVID-19.
- Prophylaxie pré-exposition : La dose initiale chez les patients adultes et les patients adolescents âgés de 12 ans et plus et pesant au moins 40 kg est de 600 mg de casirivimab et 600 mg d'imdevimab administrés en une seule perfusion intraveineuse ou par injection sous-cutanée. Les doses suivantes de 300 mg de casirivimab et 300 mg d’imdevimab peuvent être administrées en une seule perfusion intraveineuse ou par injections sous-cutanée toutes les 4 semaines jusqu’à ce que la prophylaxie ne soit plus nécessaire. Il n’existe pas de données pour des administrations répétées au-delà de 24 semaines (6 doses).
Mécanisme d'action :
Le casirivimab et l'imdevimab se lient à des épitopes non chevauchants du domaine de fixation au récepteur (RBD) de la protéine de spicule du SARS-CoV-2. Cette liaison empêche la fixation du RBD au récepteur de l’ACE2 humain, empêchant ainsi le virus de pénétrer dans les cellules
Effets indésirables les plus fréquents : (se référer au RCP pour avoir la liste complète des effets indésirables)
Contre-indications : Hypersensibilité au casirivimab ou à l'imdevimab ou à l'un des excipients
Principales références :
- Deeks ED. Casirivimab/Imdevimab: First Approval. Drugs. 2021 Nov;81(17):2047-2055. doi: 10.1007/s40265-021-01620-z. PMID: 34716907; PMCID: PMC8556815.
- Weinreich DM, Sivapalasingam S, Norton T, Ali S, Gao H, Bhore R, Xiao J, Hooper AT, Hamilton JD, Musser BJ, Rofail D, Hussein M, Im J, Atmodjo DY, Perry C, Pan C, Mahmood A, Hosain R, Davis JD, Turner KC, Baum A, Kyratsous CA, Kim Y, Cook A, Kampman W, Roque-Guerrero L, Acloque G, Aazami H, Cannon K, Simón-Campos JA, Bocchini JA, Kowal B, DiCioccio AT, Soo Y, Geba GP, Stahl N, Lipsich L, Braunstein N, Herman G, Yancopoulos GD; Trial Investigators. REGEN-COV Antibody Combination and Outcomes in Outpatients with Covid-19. N Engl J Med. 2021 Dec 2;385(23):e81. doi: 10.1056/NEJMoa2108163. Epub 2021 Sep 29. PMID: 34587383; PMCID: PMC8522800.
- O'Brien MP, Forleo-Neto E, Musser BJ, Isa F, Chan KC, Sarkar N, Bar KJ, Barnabas RV, Barouch DH, Cohen MS, Hurt CB, Burwen DR, Marovich MA, Hou P, Heirman I, Davis JD, Turner KC, Ramesh D, Mahmood A, Hooper AT, Hamilton JD, Kim Y, Purcell LA, Baum A, Kyratsous CA, Krainson J, Perez-Perez R, Mohseni R, Kowal B, DiCioccio AT, Stahl N, Lipsich L, Braunstein N, Herman G, Yancopoulos GD, Weinreich DM; Covid-19 Phase 3 Prevention Trial Team. Subcutaneous REGEN-COV Antibody Combination to Prevent Covid-19. N Engl J Med. 2021 Sep 23;385(13):1184-1195. doi: 10.1056/NEJMoa2109682. Epub 2021 Aug 4. PMID: 34347950; PMCID: PMC8362593.
- O'Brien MP, Forleo-Neto E, Sarkar N, Isa F, Hou P, Chan KC, Musser BJ, Bar KJ, Barnabas RV, Barouch DH, Cohen MS, Hurt CB, Burwen DR, Marovich MA, Brown ER, Heirman I, Davis JD, Turner KC, Ramesh D, Mahmood A, Hooper AT, Hamilton JD, Kim Y, Purcell LA, Baum A, Kyratsous CA, Krainson J, Perez-Perez R, Mohseni R, Kowal B, DiCioccio AT, Geba GP, Stahl N, Lipsich L, Braunstein N, Herman G, Yancopoulos GD, Weinreich DM; COVID-19 Phase 3 Prevention Trial Team. Effect of Subcutaneous Casirivimab and Imdevimab Antibody Combination vs Placebo on Development of Symptomatic COVID-19 in Early Asymptomatic SARS-CoV-2 Infection: A Randomized Clinical Trial. JAMA. 2022 Feb 1;327(5):432-441. doi: 10.1001/jama.2021.24939. PMID: 35029629; PMCID: PMC8808333.
- Corti D, Purcell LA, Snell G, Veesler D. Tackling COVID-19 with neutralizing monoclonal antibodies. Cell. 2021 Jun 10;184(12):3086-3108. doi: 10.1016/j.cell.2021.05.005. Epub 2021 May 26. Erratum in: Cell. 2021 Aug 19;184(17):4593-4595. PMID: 34087172; PMCID: PMC8152891.
Liens :
- Human medicine European public assessment report (EPAR)
- HAS
- Base de données publique des médicaments (pas disponible au 5/5/2022)
- ANSM
- Meddispar (pas disponible au 5/5/2022)
- Centre de référence sur les agents tératogènes (CRAT) (pas disponible au 5/5/2022)
- IMGT/mAb-DB pour casarivimab et imdevimab
- HeTOP[2] pour casirivimab et imdevimab
Remarque :
Dernière mise à jour : 6 mai 2022
Relecture par : Pr C. Carnoy