Secukinumab (COSENTYX®)
Structure : AcM humain, IgG1k
Code ATC : L02BG04
Nomenclature Ge : IgG1κ G1e0
Cible: IL-17A
Mode de production : Produit à partir de cellules d'ovaire de hamster chinois (CHO)
Forme galénique : Solution injectable à 150 mg/ml ou 300 mg/2 ml en seringue préremplie. Il existe des seringues de 75 mg pour les enfants de moins de 50 kg. Il n'existe plus de poudre pour solution injectable.
Mode d'administration : SC
Date de la première AMM : EMA 2015 / FDA 2015
Laboratoire : Novartis
Indications :
Adultes :
Traitement du psoriasis en plaques modéré à sévère chez l'adulte qui nécessite un traitement systémique.
Enfants à partir de 6 ans et adolescents :
Traitement du psoriasis en plaques modéré à sévère chez l'enfant et l'adolescent à partir de 6 ans qui nécessitent un traitement systémique.
Seul ou en association avec le méthotrexate, il est indiqué dans le traitement du rhumatisme psoriasique actif chez les patients adultes qui ont présenté une réponse inadéquate à un ou plusieurs traitements de fond (DMARDs).
Spondylarthrite ankylosante (spondyloarthrite axiale radiographique) active chez les patients adultes, en cas de réponse inadéquate à un traitement conventionnel (études MEASURE 1 et 2).
Spondyloarthrite axiale non radiographique active chez les patients adultes, avec des signes objectifs d'inflammation, se traduisant par un taux élevé de protéine C réactive (CRP) et/ou de signes visibles à l'imagerie par résonance magnétique (IRM), en cas de réponse inadéquate aux anti-inflammatoires non stéroïdiens (AINS).
Arthrite juvénile idiopathique :
- Arthrite liée à l'enthésite (ERA) : Seul ou en association avec le méthotrexate (MTX) chez les patients âgés de 6 ans et plus dont la maladie n'a pas répondu de manière satisfaisante ou qui ne peuvent pas tolérer le traitement conventionnel.
- Rhumatisme psoriasique juvénile (RPJ) : seul ou en association avec le méthotrexate (MTX), chez les patients âgés de 6 ans et plus dont la maladie n'a pas répondu de manière adéquate au traitement conventionnel ou qui ne le tolèrent pas,
ou qui ne peuvent pas tolérer le traitement conventionnel.
Maladie de Verneuil : active, modérée à sévère, chez les adultes uniquement et en 2e intention.
Prix indicatif 2021: 947.58 € pour 2 seringues ou stylos préremplies à 150 mg (1ml) ou 1 seringue ou stylo préremplie à 300 mg (2 ml)
Usage : Médicament soumis à prescription initiale hospitalière annuelle. Prescription initiale et renouvellement réservés aux spécialistes en dermatologie, en médecine interne, en rhumatologie ou en pédiatrie. Disponible à l'officine.
Posologies :
Psoriasis en plaques :
Adultes : 300 mg de sécukinumab, en injection sous-cutanée, administrée aux semaines 0, 1, 2, 3 et 4 en traitement d'initiation, puis tous les mois en traitement d'entretien.
Enfants âgés de 6 et plus et adolescents:
Chaque dose est administrée en injection sous-cutanée aux semaines 0, 1, 2, 3 et 4 en traitement d'initiation, puis tous les mois en traitement d'entretien.
- poids > 50 kg dose de 150 mg
- poids > 25 kg < 50 kg dose de 75 mg
- poids < 25 kg dose de 75 mg
Rhumatisme psoriasique :
Pour les patients atteints de psoriasis en plaques modéré à sévère concomitant ou qui répondent de façon inadéquate aux anti-TNFα (anti-TNFα-IR), la dose recommandée est de 300 mg en injection sous-cutanée, administrée aux semaines 0, 1, 2, 3 et 4 en traitement d'initiation, puis tous les mois en traitement d'entretien.
Pour les autres patients, la dose recommandée est de 150 mg en injection sous-cutanée, administrée aux semaines 0, 1, 2, 3 et 4 en traitement d'initiation, puis tous les mois en traitement d'entretien. Selon la réponse clinique, la posologie peut être augmentée à 300 mg.
Spondyloarthrite axiale :
Spondylarthrite ankylosante (spondyloarthrite axiale radiographique) :
La dose recommandée est de 150 mg en injection sous-cutanée, administrée aux semaines 0, 1, 2, 3 et 4 en traitement d'initiation, puis tous les mois en traitement d'entretien. Selon la réponse clinique, la posologie peut être augmentée à 300 mg.
Spondyloarthrite axiale non radiographique :
La dose recommandée est de 150 mg en injection sous-cutanée, administrée aux semaines 0, 1, 2, 3 et 4 en traitement d'initiation, puis tous les mois en traitement d'entretien.
Arthrite juvénile idiopathique : La dose recommandée est basée sur le poids corporel et administré en SC aux semaines 0,1,2,3,4 en traitement d'initiation puis tous les mois en traitement d'entretien. La dose est de 75 mg pour les poids <50 kg. Si le patient pèse 50 kg ou plus, la dose recommandée est de 150 mg.
Maladie de Verneuil : La dose recommandée est de 300 mg aux semaines 0, 1, 2, 3 et 4 en traitement d'initiation puis tous les mois en traitement d'entretien. Selon la réponse clinique, la dose peut être augmentée à 300 mg toutes les 2 semaines
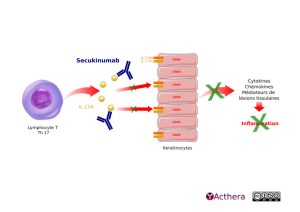
Mécanisme d'action :
Secukinumab reconnaît l'interleukine IL-17A, impliquée dans la pathogénèse du psoriasis. Dans le psoriasis les cellules dendritiques activées produisent des cytokines qui activent à leur tour principalement les lymphocytes Th17. Ces derniers sécrètent les interleukines IL-17 et IL-22 qui provoquent les lésions et l'inflammation retrouvées dans le psoriasis. L'IL-17 favorise également le recrutement de neutrophiles qui amplifie le phénomène inflammatoire.
Effets indésirables les plus fréquents: infections des voies respiratoires hautes (rhinopharyngite ou rhinite dans la plupart des cas), infections cutanéo-muqueuses non graves à Candida
Effets indésirables graves (CRPV Tours Dec 2021-juin 2022) : infections cutanées graves, atteintes digestives (Crohn de Novo) et atteintes cardiovasculaire (AVC artériels chez les patients à risque)
Contre-indications : hypersensibilité à la substance active ou à l'un des excipients, infections évolutive et cliniquement graves (par exemple une tuberculose active)
Principales références :
- Berg SH, Balogh EA, Ghamrawi RI, Feldman SR. A review of secukinumab in psoriasis treatment. Immunotherapy. 2021 Feb;13(3):201-216. doi: 10.2217/imt-2020-0195. Epub 2020 Nov 18. PMID: 33203276.
- Bodemer C, Kaszuba A, Kingo K, Tsianakas A, Morita A, Rivas E, Papanastasiou P, Keefe D, Patekar M, Charef P, Zhang L, Cafoncelli S, Papavassilis C. Secukinumab demonstrates high efficacy and a favourable safety profile in paediatric patients with severe chronic plaque psoriasis: 52-week results from a Phase 3 double-blind randomized, controlled trial. J Eur Acad Dermatol Venereol. 2021 Apr;35(4):938-947. doi: 10.1111/jdv.17002. Epub 2021 Jan 19. PMID: 33068444; PMCID: PMC7986088.
- Michelsen B, Georgiadis S, Di Giuseppe D, Loft AG, Nissen MJ, Iannone F, Pombo-Suarez M, Mann H, Rotar Z, Eklund KK, Kvien TK, Santos MJ, Gudbjornsson B, Codreanu C, Yilmaz S, Wallman JK, Brahe CH, Möller B, Favalli EG, Sánchez-Piedra C, Nekvindova L, Tomsic M, Trokovic N, Kristianslund EK, Santos H, Löve TJ, Ionescu R, Pehlivan Y, Jones GT, van der Horst-Bruinsma I, Ørnbjerg LM, Østergaard M, Hetland ML. Real-world 6 and 12-month Drug Retention, Remission and Response Rates of Secukinumab in 2,017 Psoriatic Arthritis patients in 13 European Countries. Arthritis Care Res (Hoboken). 2021 Jan 18. doi: 10.1002/acr.24560. Epub ahead of print. PMID: 33460531.
- Baraliakos X, Van den Bosch F, Machado PM, Gensler LS, Marzo-Ortega H, Sherif B, Quebe-Fehling E, Porter B, Gaillez C, Deodhar A. Achievement of Remission Endpoints with Secukinumab Over 3 Years in Active Ankylosing Spondylitis: Pooled Analysis of Two Phase 3 Studies. Rheumatol Ther. 2021 Mar;8(1):273-288. doi: 10.1007/s40744-020-00269-6. Epub 2020 Dec 22. PMID: 33351179; PMCID: PMC7991028.
- Deodhar A, Blanco R, Dokoupilová E, Hall S, Kameda H, Kivitz AJ, Poddubnyy D, van de Sande M, Wiksten AS, Porter BO, Richards HB, Haemmerle S, Braun J. Improvement of Signs and Symptoms of Nonradiographic Axial Spondyloarthritis in Patients Treated With Secukinumab: Primary Results of a Randomized, Placebo-Controlled Phase III Study. Arthritis Rheumatol. 2021 Jan;73(1):110-120. doi: 10.1002/art.41477. Epub 2020 Nov 24. PMID: 32770640; PMCID: PMC7839589.
Liens :
- Human medicine European public assessment report (EPAR)
- Avis de la HAS sur Cosentyx
- Base de données publique des médicaments
- IMGT
- HeTOP
- Vidal
- CRAT
Remarque :
Dernière mise à jour : 04/24
Par : Mathilde GLAZIOU