Ramucirumab (CYRAMZA®)
Structure : AcM humain, IgG1
Code ATC : L01XC
Cible: Récepteur au VEGF (vascular endothelial growth factor) 2
Mode d'administration : IV
Date de la première AMM : EMA 2014 / FDA 2014
Laboratoire : ImClone Systems LLC
Indications :
- En association avec le paclitaxel, pour le traitement des patients adultes atteints d'un cancer gastrique ou d'un adénocarcinome de la jonction gastro-oesophagienne avancés
- En monothérapie pour le traitement des patients adultes atteints d'un cancer gastrique ou d'un adénocarcinome de la jonction gastro-oesophagienne avancés
pour lesquels un traitement en association avec le paclitaxel n'est pas approprié.
- En association avec la chimiothérapie FOLFIRI (irinotécan, acide folinique et 5¬fluorouracile), dans le traitement des patients adultes atteints d'un cancer colorectal
métastatique (CCRM) dont la maladie a progressé pendant ou après un traitement par bevacizumab, oxaliplatine et une fluoropyrimidine.
- En association avec le docétaxel, dans le traitement des patients adultes atteints d'un cancer bronchique non à petites cellules localement avancé ou métastatique
Prix indicatif :
Usage : traitement initié par un oncologue, réservé à l'usage hospitalier
Posologies : 80 mg/m² administrée en 60 minutes au J1, J8 et J15 d'un cycle de 28 jours
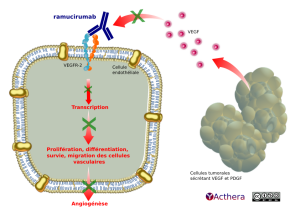
Mécanisme d'action :
Ramucirumab empêche la liaison du VEGF-A, VEGF-C et VEGF-F humain en se fixant au récepteur VEGFR-2 présent sur les cellules endothéliales. Le blocage de cette voie inhibe la différenciation, la survie et la migration des cellules vasculaires conduisant à son effet anti-angiogénique. Cet anticorps a reçu la désignation de médicament orphelin.
Effets indésirables les plus fréquents: fatigue, leucopénie, neutropénie, diarrhées, épistaxis, hypertension
Contre-indications : hypersensibilité au médicament
Principales références :
- Wilke et al., 2014, Fuchs et al., 2014
- Lien vers Human medicine European public assessment report (EPAR)
- Avis de la HAS sur Cyramza