Tremelimumab (IMJUDO®)
Autres noms : tremelimumab-actl
Structure : AcM humain IgG2 kappa
Code ATC : L01FX20
Nomenclature Ge : xxx
Cible: CTLA-4
Mode de production : Produit dans des cellules de myélome murin par la technique de l’ADN recombinant.
Forme galénique : Solution à 20 mg/ml à diluer pour perfusion. Flacon de 1,25 ml (25 mg) ou de 15 ml (300 mg) de solution à diluer.
Mode d'administration : IV
Conservation :
Le flacon non ouvert se conserve 4 ans, entre 2 et 8°C.
La stabilité physico-chimique de la solution diluée a été démontrée pendant une durée allant jusqu’à 28 jours à une température comprise entre 2 °C et 8 °C et jusqu’à 48 heures à température ambiante (ne dépassant pas 25 °C) à partir de la préparation. D’un point de vue microbiologique, la solution diluée doit être utilisée immédiatement. En cas d’utilisation non immédiate, les durées de conservation après dilution et les conditions de conservation avant utilisation relèvent de la seule responsabilité de l’utilisateur et ne devraient normalement pas dépasser 24 heures à une température comprise entre 2 °C et 8 °C ou 12 heures à température ambiante (maximum 25 °C), sauf si la dilution a été réalisée en conditions d’asepsie dûment contrôlées et validées.
L’absence de croissance microbienne dans la solution pour perfusion préparée a été démontrée pendant une durée allant jusqu’à 28 jours à une température comprise entre 2 °C et 8 °C et jusqu’à 48 heures à température ambiante (ne dépassant pas 25 °C) à partir de la préparation.
Date de la première AMM : EMA décembre 2023 / FDA octobre 2022
Laboratoire : AstraZeneca AB
Indications :
- En association avec le Durvalumab, dans le traitement de première ligne des patients adultes atteints d’un carcinome hépatocellulaire (CHC) avancé ou non résécable
- En association avec le Durvalumab et une chimiothérapie à base de platine, dans le traitement de première ligne des patients adultes atteints d’un cancer bronchique non à petites cellules (CBNPC) métastatique en l’absence de mutation activatrice de l’EGFR ou de l’ALK.
Prix indicatif (année) : xxx
Usage : Médicament réservé à l’usage hospitalier. Prescription réservée aux spécialistes en oncologie ou aux médecins compétents en cancérologie.
Posologies : 300 mg d’IMJUDO en une seule dose administrée en association avec 1 500 mg de durvalumab au jour 1 du cycle 1, suivi du durvalumab en monothérapie toutes les 4 semaines. Pour IMJUDO, chez les patients présentant un CHC pesant 40 kg ou moins, la dose doit être établie en fonction du poids, équivalant à 4 mg/kg de IMJUDO jusqu’à ce que le poids soit supérieur à 40 kg. Pour durvalumab, chez les patients pesant 30 kg ou moins, la dose doit être établie en fonction du poids, équivalant à 20 mg/kg de durvalumab jusqu’à ce que le poids soit supérieur à 30 kg.
La perfusion se fait sur 1 heure.
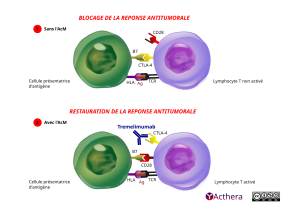
Mécanisme d'action :
L’antigène 4 des lymphocytes T cytotoxiques (cytotoxic T lymphocyte-associated antigen-4, CTLA-4) est principalement exprimé à la surface des lymphocytes T. L’interaction de CTLA-4 avec ses ligands, CD80 et CD86, limite l’activation des lymphocytes T effecteurs par un certain nombre de mécanismes potentiels, mais principalement en limitant la signalisation de costimulation via CD28. Le trémélimumab bloque les interactions entre CTLA-4 et à la fois CD80 et CD86, augmentant ainsi l’activation et la prolifération des lymphocytes T, ce qui entraîne une augmentation de la diversité des lymphocytes T et une activité antitumorale accrue.
Effets indésirables les plus fréquents : éruptions cutanées, prurit, diarrhées, douleurs abdominales, augmentation de l'aspartate aminotransférase, fièvre, hypothyroïdie, toux (se référer au RCP pour avoir la liste complète des effets indésirables).
Contre-indications : Hypersensibilité à la substance active ou à l’un des excipients
Principales références :
-
Liens :
- Human medicine European public assessment report (EPAR)
- HAS
- Base de données publique des médicaments
- ANSM
- Meddispar - pas de données au 06/11/23
- Centre de référence sur les agents tératogènes (CRAT) - pas de données au 06/11/23
Remarque :
Création de la fiche : Pr C. Carnoy
Dernière mise à jour : 11/23
Relecture par : Mathilde Glaziou