Siltuximab (SYLVANT®)
Structure : AcM chimérique, IgG1k
Code ATC : L04AC11 (Antinéoplasiques et immunomodulateurs L04 Immunosuppresseurs L04A Immunosuppresseurs L04AC Inhibiteurs d'interleukine L04AC11 Siltuximab)
Nomenclature Ge : IgG1κ G1e0
Cible: IL-6
Mode de production : Le siltuximab est produit dans une lignée de cellules d'ovaire de hamster chinois (Chinese Hamster Ovary, CHO) par technique de l'ADN recombinant
Forme galénique : SYLVANT 100 mg poudre pour solution à diluer pour perfusion ou SYLVANT 400 mg poudre pour solution à diluer pour perfusion
Mode d'administration : IV
Conservation : À conserver au réfrigérateur (entre 2 °C et 8 °C). Ne pas congeler.
Date de la première AMM : EMA 2014 / FDA 2014
Laboratoire : EUSA Pharma (Netherlands) BV
Indications :
Maladie de Castleman (hyperplasie des ganglions lymphatiques) multicentrique (touchant plusieurs ganglions lymphatiques ainsi que des organes proches) pour les patients séronégatifs pour le virus de l'immunodéficience humaine (VIH) et l'herpès virus humain 8 (HHV-8). Fait partie des maladies rares.
Prix indicatif (octobre 2021): 515,61 euros pour 1 flacon de 100mg, 2062,42 euros pour un flacon de 400 mg.
Usage : Réservé à l'usage hospitalier (pas de disponibilité à l'officine).
Posologies : La dose recommandée de siltuximab est de 11 mg/kg administrée par perfusion intraveineuse d'1 heure, toutes les 3 semaines jusqu'à échec du traitement.
Mécanisme d'action :
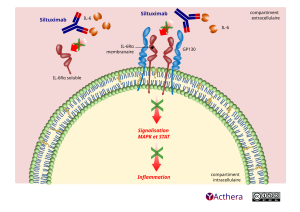
Le siltuximab est un anticorps monoclonal chimérique qui forme des complexes stables de haute affinité avec les formes bioactives solubles de l'IL-6 humaine, une cytokine inflammatoire contribuant notamment à la pathogénèse de la maladie de Castleman multicentrique. Le siltuximab empêche la liaison de l'IL-6 humaine aux récepteurs solubles et membranaires de l'IL-6 (IL-6R) présent sur les lymphocytes B et les plasmocytes localisés dans la zone B des centres germinatifs, inhibant ainsi la formation du complexe de signalisation hexamérique avec la gp130 à la surface cellulaire. L'interleukine-6 est une cytokine pro-inflammatoire pléiotrope produite par différents types de cellules, notamment les lymphocytes T et les lymphocytes B, d'autres types de lymphocytes, les monocytes et les fibroblastes, ainsi que les cellules malignes. Il a été déterminé que l'IL-6 participait à différents processus physiologiques normaux, tels que l'induction de la sécrétion d'immunoglobulines, l'initiation de la synthèse des protéines hépatiques de la phase aiguë et la stimulation de la prolifération et de la différenciation des cellules précurseurs hématopoïétiques. L'hyperproduction d'IL-6, au cours des maladies inflammatoires chroniques et des affections malignes, a été liée à l'anémie et à la cachexie, et il a été supposé qu'elle jouait un rôle central dans la prolifération des plasmocytes et les manifestations systémiques observées chez les patients atteints de MC.
Effets indésirables les plus fréquents:
Infection des voies respiratoires supérieures, infection des voies urinaires, rhinopharyngite
Neutropénie, thrombocytopénie, Réaction anaphylactique
Hypertriglycéridémie, hyperuricémie, Hypercholestérolémie
Sensation vertigineuse, céphalées, Douleurs oro-pharyngées, Hypertension artérielle
Nausées, douleurs abdominales, vomissements, constipation, diarrhée, reflux gastro-œsophagien, ulcérations buccales
Éruption cutanée, prurit, eczéma, Arthralgies, douleurs aux extrémités, Atteinte de la fonction rénale, Œdème localisé, Augmentation du poids
Contre-indications : hypersensibilité au médicament
Utilisation chez la femme enceinte : Pas de données sur le CRAT. Selon l'EMA, il n'existe pas de donnée sur l'utilisation de siltuximab chez la femme enceinte. Les études effectuées chez l'animal avec siltuximab n’ont pas mis en évidence d'effets indésirables sur la grossesse ou sur le développement embryofœtal.
Principales références :
Liens :
- Lien vers Human medicine European public assessment report (EPAR)
- Avis de la HAS sur Sylvant
- Lien vers la fiche info de la base de données publique des médicaments
- IMGT
- HeTOP
- Vidal
Remarque :
Dernière mise à jour : Août 2022
Relecture par : Mathilde GLAZIOU