Ixekizumab (TALTZ®)
Structure : AcM humanisé IgG4
Code ATC : L04AC13
Nomenclature Ge : IgG4κ G4e1
Cible: IL-17A et F
Mode de production : production sur cellules CHO
Forme galénique : Solution injectable en seringue préremplie de 1 ml contenant 80 mg d'ixekizumab.
Mode d'administration : SC
Date de la première AMM : EMA 2016 / FDA 2016
Laboratoires : Eli Lilly
Indications :
Adultes :
Traitement du psoriasis en plaques modéré à sévère chez l'adulte qui nécessite un traitement systémique
Enfants à partir de 6 ans et adolescents :
Traitement du psoriasis en plaques modéré à sévère chez l'enfant à partir de 6 ans et ayant un poids corporel d'au moins 25 kg et l'adolescent qui nécessitent un traitement systémique.
Seul ou en association avec le méthotrexate, Ixekizumab est indiqué dans le traitement du rhumatisme psoriasique actif chez les patients adultes qui ont présenté une réponse inadéquate, ou une intolérance, à un ou plusieurs traitements de fond (DMARDs).
/!\ Depuis avril 2024, « compte tenu du risque potentiel rare mais grave de réactions systémiques à l'injection incluant des réactions anaphylactiques (...), mais aussi avec les autres traitements de fond biologiques », la prise en charge de la spécialité, dans cette indication, est subordonnée au fait que la première injection sous-cutanée de ce médicament soit réalisée dans une structure de soins adaptée »
Spondylarthrite ankylosante (spondyloarthrite axiale radiographique) active chez les patients adultes, en cas de réponse inadéquate à un traitement conventionnel.
Spondyloarthrite axiale non radiographique active chez les patients adultes, avec des signes objectifs d'inflammation, se traduisant par un taux élevé de protéine C réactive (CRP) et/ou de signes visibles à l'imagerie par résonance magnétique (IRM), en cas de réponse inadéquate aux anti-inflammatoires non stéroïdiens (AINS).
Prix indicatif 2021 : 877,34 euros (1 seringue ou stylo prérempli).
Usage : Médicament soumis à prescription initiale hospitalière annuelle. Prescription initiale et renouvellement réservés aux spécialistes en dermatologie, en médecine interne, en rhumatologie ou en pédiatrie. Disponible à l'officine en ville.
Posologies :
Psoriasis en plaques :
Adultes
160 mg en injection sous-cutanée (deux injections de 80 mg), suivie de 80 mg (une injection) toute les 2 semaines jusqu’à la 12ème semaine, puis d'une dose d'entretien de 80 mg (une injection) toutes les 4 semaines (1x/4 sem.).
Enfants âgés de 6 et plus et adolescents:
- poids > 50 kg une dose initiale à 160 mg (deux injections de 80 mg), suivie de 80 mg administrés toutes les 4 semaines
- poids > 25 kg < 50 kg une dose initiale de 80 mg, suivie de 40 mg administrés toutes les 4 semaines
Rhumatisme psoriasique :
160 mg en injection sous-cutanée (deux injections de 80 mg), suivie de 80 mg (une injection) toutes les 4 semaines. Chez les patients atteints de rhumatisme psoriasique avec un psoriasis en plaques modéré à sévère concomitant, la posologie recommandée est identique à celle du traitement du psoriasis en plaques.
Spondyloarthrite axiale (radiographique et non-radiographique) :
160 mg (deux injections de 80 mg) en injection sous-cutanée, suivie de 80 mg toutes les 4 semaines
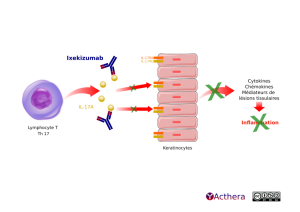
Mécanisme d'action :
Ixekizumab se lie avec une affinité élevée (< 3pM) à l'interleukine 17A (à la fois IL-17A et IL-17A / F). Des concentrations élevées d'IL-17A ont été impliquées dans la pathogenèse du psoriasis en favorisant la prolifération et l'activation des kératinocytes. La neutralisation de l'IL-17A par ixekizumab inhibe ces actions. Ixekizumab ne se lie pas à l'IL-17B, IL-17C, IL-17D, IL-17E ou IL-17F. Sur la base de données de biopsie de peaux psoriasiques (phase I), ixekizumab réduit l'épaisseur de l'épiderme, le nombre de kératinocytes proliférants, les lymphocytes T et les cellules dendritiques, ainsi que des marqueurs inflammatoires locaux à jour 43. Ainsi ixekizumab réduit l'érythème, l'induration et la desquamation présente dans les lésions de psoriasis en plaques
Effets indésirables les plus fréquents : réactions au site d'injection, infections des voies respiratoires supérieures (le plus souvent, rhinopharyngite).
Contre-indications : hypersensibilité à la substance active ou à l'un des excipients ; infections actives cliniquement graves (par exemple une tuberculose active)
Principales références :
- Armstrong A, Amato D, Huster W, Ojeh C, Van Voorhees AS. Achievement of the National Psoriasis Foundation treatment targets with ixekizumab: Pooled analyses from 4 clinical studies. J Am Acad Dermatol. 2021 Aug;85(2):330-336. doi: 10.1016/j.jaad.2019.09.030. Epub 2019 Sep 25. PMID: 31562945.
- Blauvelt A, Lebwohl MG, Mabuchi T, Leung A, Garrelts A, Crane H, ElMaraghy H, Patel H, Ridenour T, See K, Gallo G, Paul C. Long-term efficacy and safety of ixekizumab: A 5-year analysis of the UNCOVER-3 randomized controlled trial. J Am Acad Dermatol. 2021 Aug;85(2):360-368. doi: 10.1016/j.jaad.2020.11.022. Epub 2020 Nov 28. PMID: 33253833.
- Lespessailles E, Toumi H. Ixekizumab in the treatment of psoriatic arthritis. Immunotherapy. 2021 Jan;13(1):19-33. doi: 10.2217/imt-2020-0225. Epub 2020 Nov 9. PMID: 33167745.
- Deodhar A, Mease P, Rahman P, Navarro-Compán V, Marzo-Ortega H, Hunter T, Sandoval D, Kronbergs A, Leon L, Shan M, Leung A, De Vlam K, Strand V. Ixekizumab Improves Patient-Reported Outcomes in Non-Radiographic Axial Spondyloarthritis: Results from the Coast-X Trial. Rheumatol Ther. 2021 Mar;8(1):135-150. doi: 10.1007/s40744-020-00254-z. Epub 2020 Dec 7. PMID: 33284423; PMCID: PMC7991024.
Liens :
- Avis de la HAS sur TALTZ
- Lien vers Human medicine European public assessment report (EPAR)
- Base de données publique des médicaments
- IMGT
- HeTOP
- Vidal
Remarque :
Dernière mise à jour : Juin 2024
Relecture par : Dr P. De Nadaï, Mathilde Glaziou