Sotrovimab (XEVUDY®)
Structure : AcM humain IgG1, kappa
Code ATC : J06BD05
Nomenclature Ge : IgG1κ G1e16
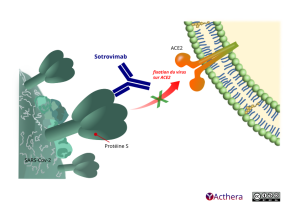
Cible: épitope hautement conservé du domaine de liaison au récepteur de la protéine de spicule du SARS-CoV-2
Mode de production : Produit dans des cellules Ovariennes de Hamster Chinois (CHO) par la technologie de l'ADN recombinant
Forme galénique : Chaque flacon contient 500 mg de sotrovimab dans 8 mL (62,5 mg/mL) (solution pour perfusion)
Mode d'administration : IV
Date de la première AMM : EMA décembre 2021 / FDA mai 2021
Laboratoires : GlaxoSmithKline
Indications : Traitement des adultes et adolescents (âgés de 12 ans et plus et pesant au moins 40 kg) atteints de la maladie à coronavirus 2019 (COVID-19) qui ne nécessitent pas de supplémentation en oxygène et qui présentent un risque accru d’évolution vers une forme sévère de la COVID-19
Prix indicatif (année) : xxx
Usage : réservé à l’usage hospitalier
Posologies : La dose recommandée est une perfusion intraveineuse unique de 500 mg administrée après dilution. Il est recommandé d’administrer Xevudy dans les 5 jours suivant l'apparition des symptômes de la COVID-19
Mécanisme d'action :
Sotrovimab neutralise le SARS-CoV-2 en se liant à un épitope situé sur le domaine de liaison au récepteur (RBD) de la protéine spike (S) du virus
Effets indésirables les plus fréquents : réactions d'hypersensibilité (2 %) et les réactions liées à la perfusion (1 %). L'effet indésirable le plus grave a été l'anaphylaxie (0,05 %) (se référer au RCP pour avoir la liste complète des effets indésirables).
Contre-indications : Hypersensibilité à la substance active ou à l’un des excipients
Principales références :
- Gupta A, Gonzalez-Rojas Y, Juarez E, Crespo Casal M, Moya J, Falci DR, Sarkis E, Solis J, Zheng H, Scott N, Cathcart AL, Hebner CM, Sager J, Mogalian E, Tipple C, Peppercorn A, Alexander E, Pang PS, Free A, Brinson C, Aldinger M, Shapiro AE; COMET-ICE Investigators. Early Treatment for Covid-19 with SARS-CoV-2 Neutralizing Antibody Sotrovimab. N Engl J Med. 2021 Nov 18;385(21):1941-1950. doi: 10.1056/NEJMoa2107934. Epub 2021 Oct 27. PMID: 34706189.
- Heo YA. Sotrovimab: First Approval. Drugs. 2022 Mar;82(4):477-484. doi: 10.1007/s40265-022-01690-7. PMID: 35286623; PMCID: PMC8919156.
- Gupta A, Gonzalez-Rojas Y, Juarez E, Crespo Casal M, Moya J, Rodrigues Falci D, Sarkis E, Solis J, Zheng H, Scott N, Cathcart AL, Parra S, Sager JE, Austin D, Peppercorn A, Alexander E, Yeh WW, Brinson C, Aldinger M, Shapiro AE; COMET-ICE Investigators. Effect of Sotrovimab on Hospitalization or Death Among High-risk Patients With Mild to Moderate COVID-19: A Randomized Clinical Trial. JAMA. 2022 Apr 5;327(13):1236-1246. doi: 10.1001/jama.2022.2832. PMID: 35285853; PMCID: PMC8922199.
- Corti D, Purcell LA, Snell G, Veesler D. Tackling COVID-19 with neutralizing monoclonal antibodies. Cell. 2021 Jun 10;184(12):3086-3108. doi: 10.1016/j.cell.2021.05.005. Epub 2021 May 26. Erratum in: Cell. 2021 Aug 19;184(17):4593-4595. PMID: 34087172; PMCID: PMC8152891.
Liens :
- Human medicine European public assessment report (EPAR)
- HAS
- Base de données publique des médicaments
- ANSM
- Meddispar (pas disponible au 11/5/2022)
- Centre de référence sur les agents tératogènes (CRAT) (pas disponible au 11/5/2022)
Remarque :
Dernière mise à jour : 11 mai 2022
Relecture par : Pr C. Carnoy