Structure d'une Immunoglobuline
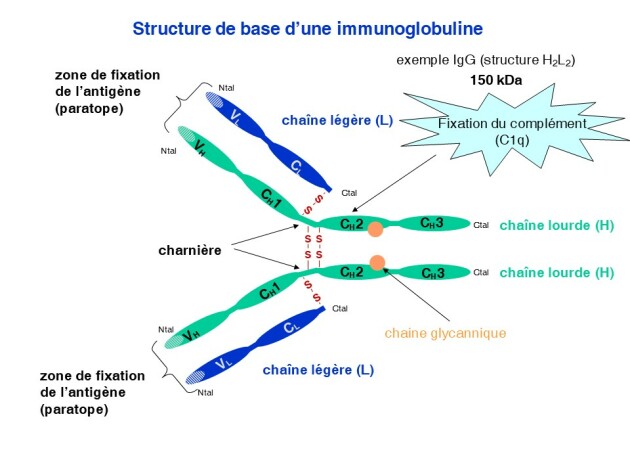
Une immunoglobuline (150 kDa) est composée de 2 chaînes peptidiques légères (L) et de 2 chaînes lourdes (H). Les chaînes L sont de type kappa ou λ. Les chaînes H existent sous forme de 5 sous types γ, µ, α, ε, et δ. La nature du sous type de la chaînes lourde déterminent le type d'immunoglobuline (IgG :γ , IgA :α , IgM :µ, IgD :δ, IgE :ε).
Les chaines des immunoglobulines sont composées de domaines structuraux de 110 acides aminés que l'on peut retrouver dans d'autres molécules telles que les récepteurs aux immunoglobulines, les marqueurs CD4, CD8 ou encore les molécules présentatrices d'antigènes (CMH de classe 1 et 2). Chaque chaîne est composée d'un domaine constant (C) et d'un domaine variable (V). La partie variable est constituée de régions hypervariables (CDR = complementarity determining regions) qui participent à la structure du paratope, qui interagit avec l'épitope. Une molécule d'immunoglobuline possède ainsi 2 paratopes identiques, d'où la possibilité de lier 2 structures antigéniques identiques par anticorps. Cette partie constante n'interagit pas avec l'antigène mais permet d'activer le complément et d'être reconnu par les récepteurs des immunoglobulines (FcR) des cellules immunitaires telles que les macrophages, les cellules natural killer (NK). Chaque chaîne légère est reliée à une chaîne lourde par des ponts disulfures (S-S) interchaînes. Ces ponts peuvent être présents au sein d'une même chaîne et on parlera de ponts intra-chaînes.
Lors d'une protéolyse ménagée par la papaïne, un coupure entre les domaines CH1 et CH2 permet d'obtenir le fragment cristallisable (Fc) et deux fragments Fab correspondant aux domaines (CH1/VH) et (CL/VL).