Rituximab (RITEMVIA®) - Biosimilaire
Attention :
Ce médicament a été retiré du marché dans l'union européenne.
Structure : AcM chimérique, IgG1k
Code ATC : L01XC02 (L : antinéoplasiques et agents immunomodulants, L01 : antinéoplasiques, L01CXC : anticorps monoclonaux, L01XC02 Rituximab)
Nomenclature Ge : IgG1κ G1e0
Cible: CD20
Mode de production : Le rituximab est un anticorps monoclonal chimérique murin/humain obtenu par génie génétique ; il s'agit d'une immunoglobuline glycosylée associant d'une part les régions constantes d’une IgG1 humaine et d'autre part les régions variables des chaînes légères et lourdes d'origine murine. Cet anticorps est produit par une culture de cellules de mammifères (ovaires de hamster chinois).
Forme galénique : solution à diluer pour perfusion (100 ou 500 mg)
Mode d'administration : IV
Conservation : Avant ouverture à conserver ente 2° et 8° durant 30 mois (Conserver à l'abri de la lumière, Conserver dans son emballage, Conserver au réfrigérateur).
Date de la première AMM : EMA juillet 2017
Indications :
- Polyarthrite rhumatoïde : En association au méthotrexate dans le traitement de la polyarthrite rhumatoïde active, sévère, chez les patients adultes qui ont présenté une réponse inadéquate ou une intolérance aux traitements de fond, dont au moins un inhibiteur du facteur de nécrose tumorale (anti-TNF).
- Lymphome non Hodgkinien (LNH) :
En association à une chimiothérapie pour le traitement des patients adultes présentant un lymphome folliculaire de stade III-IV n’ayant jamais été précédemment traités.
En traitement d’entretien chez les patients adultes présentant un lymphome folliculaire répondant à un traitement d’induction.
En monothérapie pour le traitement des patients adultes atteints de lymphomes folliculaires de stade III-IV en cas de chimiorésistance ou à partir de la deuxième rechute après chimiothérapie.
En association à une chimiothérapie "CHOP" (cyclophosphamide, doxorubicine, vincristine, prednisolone) pour le traitement des patients adultes présentant un lymphome nonhodgkinien agressif diffus à grandes cellules B, CD20 positif.
En association à une chimiothérapie pour le traitement des patients pédiatriques (âgés de ≥ 6 mois à < 18 ans) non précédemment traités présentant à un stade avancé : un lymphome diffus à grandes cellules B (LDGCB) CD20 positif, un lymphome de Burkitt (LB)/une leucémie de Burkitt (leucémie aiguë à cellules B matures) (LA-B) ou un lymphome Burkitt-like (LB-like)
- Leucémie lymphoïde chronique : En association à une chimiothérapie, non précédemment traités et en rechute ou réfractaires.
- Granulomatose avec polyangéite (maladie de Wegener) et polyangéite microscopique (AMM en 2011) :
En association aux glucocorticoïdes pour le traitement des patients adultes atteints de granulomatose avec polyangéite (GPA) et de polyangéite microscopique (PAM), sévères et actives.
En association aux glucocorticoïdes pour l’induction de la rémission chez les patients pédiatriques (âgés de ≥ 2 à < 18 ans) atteints de GPA et de PAM, sévères et actives.
Prix indicatif (2022): 166,112 euros pour 1 flacon de 10 ml (100 mg) ; 830,561 euros pour 1 flacon de 50 ml (500 mg).
Usage : Prescription initiale hospitalière, réservée à usage hospitalier. Non disponible en ville. La prescription est réservée aux spécialistes en maladies du sang ou aux spécialistes en hématologie, en rhumatologie, en médecins interne, en néphrologie, en pédiatrie ou en dermatologie.
Posologies :
• Pour la leucémie lymphoïde chronique et le LNH :
Associé à la chimiothérapie : selon la surface corporelle (375 mg/m² de surface corporelle par cure et ce, jusqu’à 8 cures). Il doit être administré le premier jour de chaque cure de chimiothérapie et ceci après administration intraveineuse du glucocorticoïde du protocole, si approprié.
En monothérapie : 375 mg/m2 de surface corporelle, administrés en perfusion intraveineuse une fois par semaine pendant quatre semaines
En traitement d'entretien :
Si non précédemment traité : 1 fois tous les 2 mois jusqu’à progression de la maladie ou pendant une durée maximale de deux ans (12 perfusions au total).
Si rechute : 1 fois tous les trois mois jusqu’à progression de la maladie ou pendant une durée maximale de deux ans (8 perfusions au total).
• Pour la polyarthrite rhumatoïde : 1000 mg en IV, puis 2ème perfusion à 2 semaines d'intervalle de 1000 mg.
• Pour la GPA et PAM :
Induction rémission : 375 mg/m² de surface corporelle, administrés en perfusion intraveineuse 1 fois par semaine pendant 4 semaines (quatre perfusions au total)
Entretien : 16 semaines après la dernière perfusion de Ritemvia, 2 perfusions IV de 500 mg espacées de deux semaines, suivies d'une perfusion IV de 500 mg tous les 6 mois. Les patients doivent recevoir Ritemvia pendant au moins 24 mois après rémission complète (absence de signes et de symptômes cliniques). Chez les patients qui présentent un risque plus élevé de rechute, les médecins peuvent envisager un traitement d'entretien par Ritemvia d'une durée plus longue, jusqu'à 5 ans.
• Pour le pemphigus vulgaris : 1000 mg en IV, puis 2ème perfusion à 2 semaines d'intervalle de 1000 mg. En entretien, une perfusion IV d'entretien de 500 mg doit être administrée aux 12e et 18e mois, puis tous les 6 mois si besoin, en fonction de l'évaluation clinique. En cas de rechute, les patients peuvent recevoir une perfusion IV de 1000 mg
Mécanisme d'action :
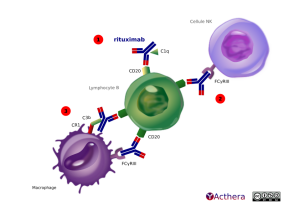
Le rituximab est un anticorps anti-CD20 (récepteur associé au BcR) est utilisé dans les lymphomes folliculaires surexprimant le CD20 et dans les PR sévères ou résistantes au méthotrexate ou à au moins un anti-TNF. Il permet la mort cellulaire via 3 voies immunologiques : 1. La fixation de l'AcM sur le CD20 active le complément pour former un complexe d'attaque membranaire ce qui provoque la lyse de la cellule par mécanisme de CDC. 2. La liaison du rituximab aux LcB permet l'interaction avec les cellules NK via le FcgRIII ce qui provoque la mort par ADCC. 3. Le Fc du rituximab permet de recruter des macrophages via le FcgR et ceci aboutit à la mort cellulaire par apoptose et ADCC
Effets indésirables les plus fréquents: Œdème périphérique, arthralgie, infection respiratoire haute, infection bactérienne et virale, nausées, fièvre, asthénie.
Contre-indications : hypersensibilité au médicament, patient avec infection sévère évolutive ou déficit immunitaire ou avec une maladie cardiaque sévère non contrôlée.
Elimination complète du médicament : Sa demi-vie d’élimination plasmatique est longue (3 semaines en moyenne). Il s’élimine donc du compartiment plasmatique en 15 semaines (3.5 mois) en moyenne.
Utilisation chez la femme enceinte : Les données publiées chez les femmes enceintes exposées au rituximab au 1er trimestre de la grossesse ou dans les 6 mois précédant la conception sont peu nombreuses, mais aucun élément inquiétant n’a été signalé à ce jour. Les données publiées chez les femmes enceintes exposées au rituximab au 2ème et/ou 3ème trimestres de la grossesse sont très peu nombreuses : Une lymphopénie B (ou une absence de CD 19+ ou de CD 20+), le plus souvent sans conséquence clinique, et/ou une thrombopénie ont été observées chez des nouveau-nés de mère traitée par rituximab aux 2ème et/ou 3ème trimestres de la grossesse. Pour l'allaitement, la quantité de rituximab ingérée par l’enfant via le lait est très faible. Elle est estimée à moins de 0.5% de la dose maternelle rapportée au poids. Aucun évènement particulier n’a été rapporté chez une dizaine d’enfants allaités par des mères sous rituximab dont certains suivis jusqu’à 1 an 1/2 (moins d’une dizaine).
Principales références :
- Salles et al., 2011, Colombat et al., 2001
Liens :
- Lien vers Human medicine European public assessment report (EPAR)
- IMGT-DB
- CRAT
Remarque :
Dernière mise à jour : 10/22
Par : Mathilde GLAZIOU