Pembrolizumab (KEYTRUDA®)
Structure AcM humanisé, IgG4k (altération stabilisatrice de séquence dans la région Fc)
Code ATC : L01FF02 (L : antinéoplasiques et immunomodulateurs, L01 : agents antinéoplasiques, L01F ; anticorps monoclonal, L01FF ; inhibiteurs de PD-1/L1)
Nomenclature Ge : IgG4κ G4e1
Mode de production : Anticorps monoclonal humanisé (IgG4 isotype kappa avec altération stabilisatrice de séquence dans la région Fc) anti-PD-1, produit dans des cellules d’ovaires de hamster chinois par la technique de l’ADN recombinant.
Forme galénique : Solution à diluer pour perfusion 25mg/mL (/!\ la posologie à 50 mg/mL a été retirée du marché en 2019)
Mode d'administration : IV
Conservation : Si le flacon n'est pas ouvert, conservable 2 ans au réfrigérateur. Une fois que la préparation de la perfusion a été faite, d'un point de vue microbiologique, le produit doit être utilisé immédiatement. La solution diluée ne doit pas être congelée. Si elle n'est pas utilisée immédiatement, la stabilité chimique et physique de KEYTRUDA en cours d'utilisation a été démontrée pendant 96 heures entre 2 °C et 8 °C. Cette durée de 96 heures peut inclure jusqu'à 6 heures à température ambiante (à 25 °C ou en dessous). En cas de réfrigération, il faut laisser les flacons et/ou les poches de perfusion intraveineuse revenir à température ambiante avant utilisation.
Date de la première AMM : EMA 2015 / FDA 2014
Laboratoire : Merck
Indications :
- Mélanome avancé :
En monothérapie dans le traitement des adultes et des adolescents âgés de 12 ans et plus présentant un mélanome avancé (non résécable ou métastatique).
En monothérapie dans le traitement adjuvant des adultes et des adolescents âgés de 12 ans et plus atteints d'un mélanome de stade IIB, IIC ou III et ayant subi une résection complète.
- Cancer bronchique non à petites cellules (CBNPC) métastatique
En monothérapie dans le traitement de première ligne du carcinome pulmonaire non à petites cellules métastatique chez l'adulte dont les tumeurs expriment PD-L1 avec un score de proportion tumorale (TPS) ≥ 50 % sans mutations tumorales positives EGFR ou ALK.
En monothérapie dans le traitement du carcinome pulmonaire non à petites cellules localement avancé ou métastatique chez les adultes dont les tumeurs expriment PD-L1 avec un TPS ≥ 1% et qui ont reçu au moins un schéma de chimiothérapie préalable. Les patients présentant des mutations tumorales positives EGFR ou ALK doivent également avoir reçu une thérapie ciblée avant de recevoir KEYTRUDA.
En association avec le pemetrexed et une chimiothérapie à base de platine, dans le traitement de première ligne du carcinome pulmonaire non à petites cellules non squameux métastatique chez les adultes dont les tumeurs ne présentent pas de mutations positives de l'EGFR ou de l'ALK.
En association avec le carboplatine et soit le paclitaxel, soit le nab-paclitaxel, dans le traitement de première ligne du carcinome pulmonaire non à petites cellules squameux métastatique chez l'adulte.
- Lymphome de Hodgkin classique (LHc)
En monothérapie dans le traitement des patients adultes et pédiatriques âgés de 3 ans et plus atteints d'un lymphome hodgkinien classique récidivant ou réfractaire, en cas d'échec de la thérapie autologue de cellules souches (ASCT) ou après au moins deux thérapies antérieures lorsque l'ASCT n'est pas une option thérapeutique.
En monothérapie dans le traitement du carcinome urothélial localement avancé ou métastatique chez les adultes qui ont reçu une chimiothérapie antérieure contenant du platine
En monothérapie dans le traitement du carcinome urothélial localement avancé ou métastatique chez les adultes qui ne sont pas éligibles pour une chimiothérapie contenant du cisplatine et dont les tumeurs expriment PD-L1 avec un taux d'activité élevé (les tumeurs expriment PD-L1 avec un score positif combiné (CPS) ≥ 10 ).
En monothérapie ou en association avec une chimiothérapie à base de platine et de 5-fluorouracil (5-FU) dans le traitement de première ligne du carcinome épidermique de la tête et du cou métastatique ou non résécable chez les adultes dont les tumeurs expriment PD-L1 avec un CPS ≥ 1
En monothérapie dans le traitement du carcinome épidermique récurrent ou métastatique de la tête et du cou chez les adultes dont les tumeurs expriment PD-L1 avec un CPS ≥ 50 % et progressant sur ou après une chimiothérapie contenant du platine.
- Carcinome rénal avancé :
En association avec l'axitinib, dans le traitement en première ligne du carcinome rénal avancé chez l'adulte
En association avec le lenvatinib, dans le traitement de première ligne du carcinome avancé des cellules rénales chez l'adulte
En monothérapie dans le traitement adjuvant du carcinome des cellules rénales chez les adultes présentant un risque accru de récidive après une néphrectomie, ou après une néphrectomie et une résection de lésions métastatiques.
- Cancers à instabilité des microsatellites élevée (MSI-H) ou à réparation des mésappariements déficiente (dMMR)
Cancer colorectal (CRC) en monothérapie : traitement de première ligne du cancer colorectal métastatique ou traitement d'un cancer colorectal non résécable ou métastatique après une précédente thérapie combinée à base de fluoropyrimidine.
Cancers non colorectaux :
un carcinome de l'endomètre avancé ou récurrent, dont la maladie a progressé lors ou après traitement antérieur par un traitement contenant du platine, quel que soit le contexte, et qui ne sont pas candidats à une chirurgie ou à une radiothérapie curative
Cancer de l'estomac, de l'intestin grêle ou des voies biliaires non résécable ou métastatique, avec une progression de la maladie lors ou après au moins un traitement antérieur.
En association avec une chimiothérapie à base de platine et de fluoropyrimidine, pour le traitement en première ligne du carcinome de l'œsophage localement avancé, non résécable ou métastatique ou adénocarcinome de la jonction gastro-œsophagienne HER-2 négatif, chez les adultes dont les tumeurs expriment PD-L1 avec un CPS ≥ 10.
- Cancer du sein triple négatif :
En association avec une chimiothérapie en tant que traitement néoadjuvant, puis poursuivi en monothérapie en tant que traitement adjuvant après la chirurgie, dans le traitement des adultes atteints de cancer du sein localement avancé ou au stade précoce d'un cancer du sein triple négatif à haut risque de récidive.
En association avec une chimiothérapie dans le traitement des cancers du sein localement récurrents, non résécables ou métastatiques chez les adultes dont les tumeurs expriment PD-L1 avec un CPS ≥ 10 et qui n'ont pas reçu de chimiothérapie préalable pour une maladie métastatique.
En association avec le lenvatinib dans le traitement du carcinome de l'endomètre avancé ou récurrent chez les adultes dont la maladie a progressé lors ou à la suite d'un traitement antérieur par une thérapie contenant du platine, quel que soit le contexte, et qui ne sont pas candidats à une chirurgie ou une radiothérapie
En association à une chimiothérapie avec ou sans bevacizumab, dans le traitement du cancer du col de l'utérus persistant, récurrent ou métastatique chez les adultes dont les tumeurs expriment PD-L1 avec un CPS ≥ 1.
Prix indicatif : 2592,598 euros pour un flacon de 4 mL à 25 mg/mL (janvier 2023)
Usage : Médicament réservé à l’usage hospitalier (non disponible en ville). Prescription réservée aux spécialistes en oncologie ou en hématologie, ou aux médecins compétents en cancérologie ou en maladies du sang.
Posologies :
- Chez les adultes soit 200 mg toutes les 3 semaines, soit de 400 mg toutes les 6 semaines en perfusion intraveineuse de 30 minutes.
- Chez les patients pédiatriques âgés de 3 ans et plus atteints de LCH ou les patients âgés de 12 ans et plus atteints de mélanome : 2 mg/kg de poids corporel (jusqu'à un maximum de 200 mg), toutes les 3 semaines, en perfusion intraveineuse de 30 minutes.
Mécanisme d'action :
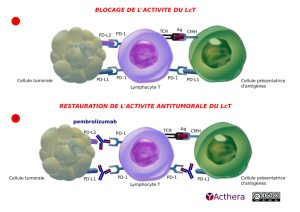
Pembrolizumab possède le même mécanisme d'action que Nivolumab. Pembrolizumab est dirigé contre une molécule du checkpoint immunologique, PD-1, qui est exprimé au cours des stimulations antigéniques sur les lymphocytes T CD4+ et CD8+ épuisés. Pembrolizumab empêche l'interaction de PD-1 avec ses deux ligands connus PDL-1 et PDL-2 présents sur les cellules tumorales, ainsi que sur les cellules dendritiques (schéma 2). L'interaction PD-1 / PDL-1 envoie des signaux répresseurs au lymphocyte T qui devient incapable de contrôler l'expansion des cellules tumorales (schéma 1). Grâce à une modification dans sa portion Fc, le pembrolizumab est dépourvu de capacité cytotoxique (ADCC et CDC) afin de ne pas dépléter les cellules exprimant PD-1 telles que les cellules NK, les LcB, les monocytes.
Effets indésirables les plus fréquents: diarrhées, nausées, prurit, rash, fatigue, anémie, thrombopénie
Contre-indications : hypersensibilité au médicament
Utilisation pendant la grossesse : Pas de données sur le CRAT. Il n'existe pas de données sur l'utilisation du pembrolizumab chez la femme enceinte. Cependant, dans des modèles murins, le blocage de la signalisation PD-L1 a montré une perturbation de la tolérance du fœtus, entraînant une augmentation des pertes fœtales. Ces résultats indiquent un risque potentiel, basé sur son mécanisme d'action ; l'administration de pembrolizumab pendant la grossesse pourrait causer des dommages pour le fœtus.
Les femmes en âge de procréer doivent utiliser une méthode de contraception efficace pendant le traitement par le pembrolizumab et pendant au moins 4 mois après la dernière dose de ce médicament.
Principales références :
- (Ribas et al., 2015), (Robert et al., 2015)
Liens :
- Lien vers Human medicine European public assessment report (EPAR)
- IMGT/DB
- Avis de la HAS sur Keytruda
- Vidal : fiche du Keytruda 25 mg/mL
- Vidal : article sur le mélanome
- ANSM - brochures et carte patient
- Fiche ono-HDF (mise à jour 2019 /!\)
Remarque :
Dernière mise à jour : 02/23
Par : Mathilde GLAZIOU