Ipilimumab (YERVOY®)
Structure : AcM humain, IgG1k
Code ATC : L01XC11
Nomenclature Ge : IgG1κ G1e0
Cible: CTLA4 (antigène 4 des lymphocytes T cytotoxiques)
Mode de production : Produit dans des cellules ovariennes de hamster chinois par la technique de l’ADN recombinant.
Forme galénique : Solution à diluer pour perfusion 5mg/mL (flacons de 10 ou 40 mL).
Mode d'administration : IV
Conservation : Après ouverture du flacon, d'un point de vue microbiologique, le produit doit être perfusé ou dilué puis perfusé immédiatement. La stabilité chimique et physique en cours d'utilisation de la solution diluée ou non (entre 1 et 4 mg/ml) a été démontrée pendant 24 heures à 25 °C et entre 2 °C et 8 °C. Si elle n'est pas utilisée immédiatement, la solution pour perfusion (diluée ou non) peut être conservée au réfrigérateur jusqu'à 24 heures (entre 2 °C et 8 °C) ou à température ambiante (entre 20 °C et 25 °C)
Date de la première AMM : EMA 2011 / FDA 2011
Laboratoires : Bristol-Myers Squibb Pharma
Indications :
- Mélanome
En monothérapie dans le traitement des patients adultes et adolescents de 12 ans et plus atteints de mélanome avancé (non résécable ou métastatique)
En association au nivolumab dans le traitement des patients adultes atteints de mélanome avancé (non résécable ou métastatique)
- Carcinomes à cellules rénales
En association au nivolumab, en première ligne, dans le traitement des patients adultes atteints d’un carcinome à cellules rénales avancé de pronostic intermédiaire/défavorable
- Cancers bronchiques non à petites cellules
En association au nivolumab et à 2 cycles de chimiothérapie à base de sels de platine, en première ligne, dans le traitement des patients adultes atteints d'un cancer bronchique non à 3 petites cellules métastatique dont les tumeurs ne présentent pas la mutation sensibilisante de l’EGFR, ni la translocation ALK.
En association au nivolumab, en première ligne, dans le traitement des patients adultes atteints d’un mésothéliome pleural malin non résécable.
En association à nivolumab, dans le traitement des patients adultes atteints d’un cancer colorectal métastatique avec une déficience du système de réparation des mésappariements de l’ADN ou une instabilité microsatellitaire élevée après une association antérieure de chimiothérapie à base de fluoropyrimidine.
- Carcinome épidermoïde de l'oesophage
En association au nivolumab, en première ligne, dans le traitement des patients adultes atteints d’un carcinome épidermoïde de l’œsophage avancé non résécable, récurrent ou métastatique dont les cellules tumorales expriment PD-L1 au seuil ≥ 1 %.
Prix indicatif : 2870,000 euros pour 10 mL et 11480,000 euros pour 40 mL
Usage : Médicament réservé à l'usage hospitalier. Prescription réservée aux spécialistes en oncologie ou aux médecins compétents en cancérologie. Médicament nécessitant une surveillance particulière pendant le traitement.
Posologies : Le traitement d'induction de Yervoy se fait à la dose de 3 mg/kg en perfusion intraveineuse sur une période de 90 minutes, toutes les 3 semaines pour un total de 4 doses
Mécanisme d'action :
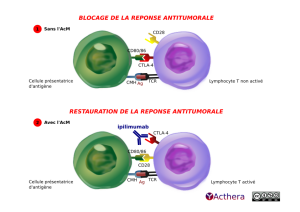
Le mélanome est un cancer, dont l'éradication par le système immunitaire est affectée par des mécanismes de régulation intrinsèque. L'ipilimumab permet de jouer sur un régulateur d'activation des LcT, le CTLA-4 qui normalement inhibe l'activation des cellules T. L'interaction ipilimumab/CTLA4 bloque la liaison au CD80/CD86, libérant l'interaction du CD28 avec CD80/86 et provoquant l'activation des cellules T, leur prolifération, leur infiltration dans les tumeurs et la mort des cellules tumorales
Effets indésirables les plus fréquents: nausées, vomissements, diminution de l'appétit, infections, cytopénies, état confusionnel/dépressions.
Contre-indications : hypersensibilité au médicament
Utilisation chez la femme enceinte : Il n’existe pas de données sur l’utilisation de YERVOY chez la femme enceinte. Les études de reproduction effectuées chez l'animal ont mis en évidence une toxicité sur la reproduction. YERVOY ne doit pas être utilisé pendant la grossesse ou chez les femmes susceptibles de procréer n’utilisant pas une méthode de contraception efficace, à moins que le bénéfice clinique attendu soit supérieur au risque potentiel
Principales références :
- Patel and Woodman, 2011 ; Hodi et al., 2010
Liens :
- Avis de la HAS sur Yervoy
- Lien vers Human medicine European public assessment report (EPAR)
- FDA
- Bases de données publique des médicaments
- ANSM
- Meddispar - pas de données au 13 mars 2023
- CRAT - pas de données au 13 mars 2023
- IMGT
- Vidal
- HeTop
Remarque :
Dernière mise à jour : Mars 2023
Par : Mathilde GLAZIOU