Infliximab (REMSIMA®) - Biosimilaire (iv) - Biobetter (sc)
Autre nom : CT-P13 ; INFLECTRA® aux US
Structure : AcM chimérique, IgG1k
Code ATC : L04AB02 (Antinéoplasiques et immunomodulateurs L04 Immunosuppresseurs L04A Immunosuppresseurs L04AB Inhibiteurs du facteur de nécrose tumorale alpha (TNF-alpha) L04AB02 Infliximab)
Nomenclature Ge : IgG1κ G1e0
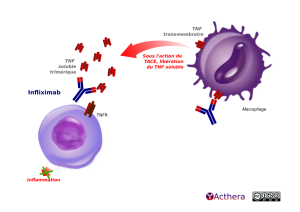
Cible: TNF (tumor necrosis factor) soluble et membranaire
Mode de production : Anticorps monoclonal chimérique humain/murin de type IgG1 produit dans des cellules hybridomes murines par la technique de l'ADN recombinant.
Forme galénique : Solution injectable à 120 mg en seringue préremplie ou stylo prérempli pour la voie SC OU Flacon à 100 mg d'infliximab à reconstituer. Après reconstitution chaque ml contient 10 mg d'infliximab
Mode d'administration : IV (perfusion) et SC
Conservation : Avant reconstitution, le produit peut se garder 3 ans entre 2 °C et 8 °C. A conserver au réfrigérateur (entre 2 °C et 8 °C). Remsima peut être conservé à des températures allant jusqu'à 25 °C maximum pendant une période unique allant jusqu'à 6 mois, mais sans dépasser la date d'expiration initiale. Après la sortie du réfrigérateur, Remsima ne doit pas être remis en conditions réfrigérées. Après reconstitution, la stabilité chimique et physique en cours d'utilisation de la solution diluée a été démontrée jusqu'à 28 jours entre 2 °C et 8 °C et pendant 24 heures supplémentaires à 25 °C après la sortie du réfrigérateur.
Date de la première AMM : FDA en février 2016 / EMA en septembre 2013
Laboratoires : Celltrion Healthcare / Biogaran
Indications :
Peut se prendre en association avec le méthotrexate. Remsima est indiqué pour la réduction des signes et des symptômes ainsi que pour l'amélioration de la fonction physique chez des patients adultes atteints d'une maladie active lorsque la réponse aux médicaments antirhumatismaux (DMARD), y compris le méthotrexate, n'est pas satisfaisante ou insuffisante. Aussi pour les patients adultes atteints d'une maladie grave, active et évolutive, non traitée auparavant par méthotrexate ou d'autres DMARDs.
- Maladie de Crohn :
Modérément à sévèrement active, chez les patients adultes qui n'ont pas répondu malgré un traitement complet et adéquat avec un corticostéroïde et/ou un immunosuppresseur, ou qui sont intolérants ou présentent des contre-indications médicales à ces traitements. Egalement utilisé dans le traitement de la maladie de Crohn active fistulisante, chez les patients adultes qui n'ont pas répondu à un traitement complet et adéquat avec un traitement conventionnel (antibiotiques, drainage et thérapie immunosuppressive).
Remsima est indiqué dans le traitement de la maladie de Crohn sévère et active, chez les enfants et les adolescents âgés de 6 à 17 ans, qui n'ont pas répondu à un traitement conventionnel comprenant un corticoïde, un immunomodulateur et une thérapie nutritionnelle primaire, ou qui sont intolérants ou ont des contre-indications à ces thérapies. Chez les enfants, Remsima n'a été étudié qu'en association avec un traitement immunosuppresseur conventionnel.
Remsima est indiqué pour le traitement de la rectocolite hémorragique modérément à sévèrement active chez les patients adultes qui ont eu une réponse inadéquate au traitement conventionnel, y compris les corticostéroïdes et la 6-mercaptopurine (6-MP) ou l'azathioprine (AZA), ou qui sont intolérants à ces traitements ou qui présentent des contre-indications médicales à ces thérapies.
Remsima est indiqué dans le traitement de la colite ulcéreuse sévèrement active, chez les enfants et les adolescents âgés de 6 à 17 ans, qui n'ont pas répondu de manière satisfaisante au traitement conventionnel comprenant corticostéroïdes et le 6-MP ou l'AZA, ou qui sont intolérants ou présentent des contre-indications médicales à ces traitements.
- Spondylarthrite ankylosante :
Remsima est indiqué dans le traitement de la spondylarthrite ankylosante sévère et active, chez les patients adultes qui n'ont pas répondu de manière adéquate au traitement conventionnel.
- Rhumatisme psoriasique de l'adulte :
Remsima est indiqué dans le traitement du rhumatisme psoriasique actif et progressif chez les patients adultes lorsque la réponse au traitement DMARD précédent a été inadéquate.
Remsima doit être administré en association avec le méthotrexate ou seul chez les patients qui présentent une intolérance au méthotrexate ou pour lesquels le méthotrexate est contre-indiqué.
- Psoriasis :
Remsima est indiqué dans le traitement du psoriasis en plaques modéré à sévère chez les patients adultes qui n'ont pas répondu à d'autres traitements systémiques, y compris les traitements par voie orale ou qui présentent une contre-indication ou qui sont intolérants à d'autres traitements systémiques, dont la ciclosporine, le méthotrexate ou la PUVA.
Prix indicatif (juillet 2022): 241,81 € pour une seringue/stylo préremplie à 120 mg. 203,37 € pour 1 flacon de poudre pour perfusion
Usage : Réservé à l'usage hospitalier. Disponible à l'officine pour la voie SC. Médicament à prescription initiale hospitalière, dont le renouvellement est réservé à certains spécialistes. Médicament d'exception.
Posologies :
Pour maladie de Crohn (enfants et adultes), la rectocolite hémorragique (enfants et adultes), la spondylarthrite ankylosante, le psoriasis et le rhumatisme psoriasique : 5 mg/kg administrés en IV suivis par des perfusions supplémentaires de 5 mg/kg aux semaines 2 et 6 après la première perfusion, puis ensuite toutes les 8 semaines.
Pour la polyarthrite rhumatoïde: 3 mg/kg administrés en IV suivis par des perfusions supplémentaires de 3 mg/kg aux semaines 2 et 6 après la première perfusion, puis ensuite toutes les 8 semaines.
Mécanisme d'action :
L'infliximab se lie aux formes solubles et membranaires du TNF ce qui forme un complexe stable, qui inhibe l'activité du TNF (qui active la voie NF-B avec synthèse de cytokines pro-inflammatoires). La cascade inflammatoire est bloquée : diminution de l'expression de molécules d'adhésion diminuant le processus de diapédèse, et de recrutements de macrophages, lymphocytes et neutrophiles. Il s'agit du 1er anti-TNF à avoir une autorisation de mise sur le marché dans la maladie de Crohn chez l'enfant
Effets indésirables les plus fréquents: infections virales (grippe), infections des voies respiratoires hautes.
Contre-indications : hypersensibilité au médicament, insuffisance cardiaque et infections opportunistes telles que la tuberculose
Elimination complète du médicament : 8 semaines après la dernière dose.
Utilisation chez la femme enceinte : Le CRAT considère qu’il n’y a pas d’association établie entre un effet malformatif particulier et l’exposition concernée (passage des Ig1 transplacentaires après la 14e SA donc après la fin de l'organogénèse). L'infliximab passe le placenta : à la naissance, les concentrations maternelles néonatales sont supérieures aux concentrations plasmatiques maternelles. Parmi plus de 3000 patientes exposées en 2e partie de grossesse à un anti-TNF alpha (infliximab et adalimumab), dont 1500 au 3e trimestre de grossesse, aucun effet attribuable au traitement n'est retenu (prématurité, infections...) chez les enfants suivis jusque l'âge de 5 ans. Donc on conseille une consultation pré-conceptionnelle pour faire le point sur la pathologie. L'infliximab peut être poursuivi pendant la grossesse en tenant compte du risque de l'immunosuppression du traitement. La concentration de l'infliximab dans le lait est très faible, voire indétectable, de même que dans le sang des enfants ayant été allaités par une mère traitée.
Principales références :
- Blackmore and Harris, 2012 ; Hanauer et al., 2002
- Braun J, Kudrin A. Progress in biosimilar monoclonal antibody development: the infliximab biosimilar CT-P13 in the treatment of rheumatic diseases. Immunotherapy. 2015;7(2):73-87.
- Schreiber S, Panés J, Kwon B, Hong S, Peyrin-Biroulet L. Biosimilar infliximab for inflammatory bowel disease: from concepts to clinical practice. Case study illustrated with CT-P13. Expert Rev Gastroenterol Hepatol. 2015;9 Suppl 1:5-15.
- McKeage K. et al. A review of CT-P13: an infliximab biosimilar. BioDrugs. 2014 Jun;28(3):313-21. doi: 10.1007/s40259-014-0094-1.
Liens :
- Fiche médicament de l'infliximab sur le site du GETAID
- Human medicine European public assessment report (EPAR)
- HAS
- Base de données publique des médicaments
- Fiche de l'Association Nationale de Défense contre l'Arthrite Rhumatoide (ANDAR) : REMICADE® [pdf]
- CRAT
- Vidal
- Base de donnée des médicaments
- ANSM : les biosimilaires de REMICADE®
Remarque :
Dernière mise à jour : août 2022
Relecture par : Mathilde GLAZIOU