Ustekinumab (WEZENLA®) - Biosimilaire
Autre nom :
Structure : AcM humain, IgG1k
Cible : sous unité p40 de l'IL-12 et de l'IL-23
Code ATC : L04AC05
Forme galénique :
- Solution injectable en seringue préremplie à 45 mg et 90 mg d'ustekinumab (disponible en ville).
- Solution injectable en flacon de 0,5 mL à 45 mg
- Solution à diluer pour perfusion en flacon de 26 mL à 130 mg
Mode de production : Produit par une lignée cellulaire d’ovaire de hamster chinois en utilisant une technique d’ADN recombinant.
Mode d'administration : SC ou IV
Date de la première AMM : FDA xxx / EMA juin 2024
Laboratoire : AMGEN
Conservation : A conserver au réfrigérateur. Ne pas congeler. Les seringues préremplies individuelles peuvent être conservées à température ambiante jusqu'à 30 °C pendant une période unique de 30 jours maximum dans le carton d'origine à l'abri de la lumière. Une fois qu'une seringue a été conservée à température ambiante (jusqu'à 30 °C), elle ne doit pas être remise au réfrigérateur.
Indications :
- Psoriasis en plaques : traitement du psoriasis en plaques modéré à sévère chez l'adulte qui n'a pas répondu, ou qui présente une contre-indication, ou qui est intolérant aux autres traitements systémiques dont la ciclosporine, le méthotrexate (MTX) ou la puvathérapie (psoralène et UVA)
- Psoriasis en plaques de la population pédiatrique : traitement du psoriasis en plaques modéré à sévère chez l'enfant et l'adolescent âgé de 6 ans et plus, en cas de réponse insuffisante ou d'intolérance aux autres traitements systémiques ou aux photothérapies (les stylos n'ont pas cette indication).
- Rhumatisme psoriasique : seul ou en association avec le méthotrexate (MTX), est indiqué dans le traitement du rhumatisme psoriasique actif chez l'adulte lorsque la réponse à un précédent traitement de fond antirhumatismal non-biologique (DMARD) a été inadéquate
- Maladie de Crohn : traitement de la maladie de Crohn active modérée à sévère chez les patients adultes présentant une réponse insuffisante, une perte de réponse ou une intolérance à un traitement conventionnel ou par anti-TNF, ou qui présentent une contre-indication médicale à ces traitements.
A noter que WEZENLA® n’a pas d’indication AMM dans la rectocolite hémorragique contrairement au STELARA®.
Prix indicatif (aout 2024): 1257.19 € TTC la seringue préremplie de 45 ou 90 mg.
Usage : Prescription réservée aux spécialistes en dermatologie, gastro-entérologie et hépatologie, médecine interne, rhumatologie. Disponible en ville.
Posologies :
- Psoriasis en plaques
La posologie recommandée de WEZENLA est d’une dose initiale de 45 mg administrée par voie sous-cutanée,
suivie d’une dose de 45 mg 4 semaines plus tard, puis toutes les 12 semaines par la suite. L’arrêt du traitement doit être envisagé chez les patients ne présentant pas de réponse après 28 semaines de traitement.
Pour les patients ayant un poids > 100 kg la dose initiale est de 90 mg administrée par voie sous-cutanée,
suivie d’une dose de 90 mg 4 semaines plus tard, puis toutes les 12 semaines par la suite.
- Rhumatisme psoriasique (RP)
La posologie recommandée de WEZENLA est d’une dose initiale de 45 mg administrée par voie sous-cutanée,
suivie d’une dose de 45 mg 4 semaines plus tard, puis toutes les 12 semaines par la suite. Il est possible d’utiliser 90 mg chez les patients ayant un poids corporel > 100 kg.
L’arrêt du traitement doit être envisagé chez les patients ne présentant pas de réponse après 28 semaines de traitement.
- Psoriasis en plaques dans la population pédiatrique (6 ans et plus)
La posologie recommandée de WEZENLA en fonction du poids corporel :
< 60 kg : pas de dose < 45 mg disponible
≥ 60 à ≤ 100 kg : 45 mg d'ustekinumab
> 100 kg : 90 mg d'ustekinumab
WEZENLA doit être administré aux semaines 0 et 4, puis toutes les 12 semaines par la suite.
- Maladie de Crohn
La première administration sous-cutanée de 90 mg de WEZENLA doit avoir lieu à la semaine 8 après la dose intraveineuse.
Les patients peuvent ensuite recevoir une administration toutes les 8 semaines ou toutes les 12 semaines selon le jugement clinique.
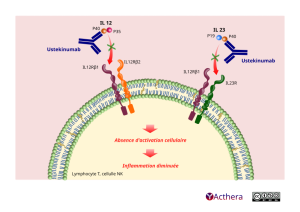
Mécanisme d'action :
L’ustékinumab est un anticorps monoclonal IgG1κ entièrement humain qui se lie spécifiquement à la sous-unité protéique p40 commune aux cytokines humaines interleukine (IL)-12 et IL-23. L’ustékinumab inhibe la bioactivité de l’IL-12 et de l’IL-23 humaines en empêchant la p40 de se lier au récepteur protéique IL-12Rβ1 exprimé à la surface de cellules immunitaires. L’ustékinumab ne peut pas se lier à l’IL-12 ou à l’IL-23 si elles sont préalablement fixées à leurs récepteurs cellulaires de surface IL-12Rβ1. Il est donc peu probable que l’ustékinumab contribue à la cytotoxicité médiée par le complément ou par les anticorps des cellules comportant des récepteurs à l’IL-12 et/ou IL-23.
IL-12 et IL-23 sont des cytokines hétérodimériques sécrétées par des cellules présentatrices d’antigènes activées telles que les macrophages et les cellules dendritiques. Chacune des cytokines participe aux fonctions immunitaires ; l’IL-12 stimule les cellules natural killer (NK) et entraîne la différenciation des lymphocytes T CD4+ vers le phénotype T helper 1 (Th1), l’IL-23 induit la différenciation en lymphocyte T helper 17 (Th17). Cependant, une anomalie de la régulation des IL-12 et IL-23 a été associée à des maladies à médiation immunitaire, telles que le psoriasis, le rhumatisme psoriasique et la maladie de Crohn.
Effets indésirables les plus fréquents : Les effets indésirables les plus fréquents (> 5%) dans les phases contrôlées des études cliniques conduites avec l’ustekinumab chez les patients adultes atteints de psoriasis, de rhumatisme psoriasique, de la maladie de Crohn et de rectocolite hémorragique étaient des rhinopharyngites et des céphalées. La plupart ont été considérés comme étant légers et n’ont pas nécessité d’interruption du traitement étudié. Les effets indésirables les plus graves rapportés avec l’ustekinumab sont des réactions d’hypersensibilité graves incluant l’anaphylaxie .
Contre-indications : hypersensibilité à la substance active ou à l’un des excipients, patient avec infection active et cliniquement importante
Elimination complète du médicament : Sa demi-vie d’élimination plasmatique est longue (3 semaines en moyenne), soit une élimination complète du plasma en 15 semaines environ.
Utilisation chez la femme enceinte :
Selon les RCP, les femmes en âge de procréer doivent utiliser une méthode de contraception efficace pendant le traitement et durant au moins 15 semaines après son arrêt.
Concernant l'aspect malformatif, les données publiées chez les femmes enceintes exposées à l’ustekinumab au 1er trimestre de la grossesse sont nombreuses et rassurantes. De plus, l’ustékinumab n’est pas tératogène chez le singe. Concernant l'aspect foetal et maternel, il y a un passage transplacentaire de l'ustékinumab à partir de 14 SA. Les données publiées chez les femmes enceintes exposées à l’ustékinumab au 2ème et/ou 3ème trimestres de la grossesse sont peu nombreuses, mais aucun effet fœtal ou néonatal particulier attribuable au traitement n’a été signalé à ce jour. Cependant, le nourrisson peut être exposé à un risque plus important d'infections.
Concernant l'allaitement, aucun événement particulier n’a été rapporté parmi une dizaine d’enfants allaités par des mères sous ustékinumab. C'est une molécule envisageable pendant l'allaitement.
Pharmacovigilance novembre 2022 : Le comité de pharmacovigilance (PRAC) de l'EMA recommande de ne pas administrer de vaccins vivants atténués aux nourrissons jusqu'à 6 mois s'ils ont été exposé à l'ustekinumab in utero (avertissement sur la notice). Cet immunosuppresseur a été détecté dans le sérum d'enfants exposés et le PRAC estime que le risque d'infection peut être plus important chez ces enfants.
Principales références :
- Feldman SR, Reznichenko N, Berti F, Duijzings P, Ruffieux R, Otto H, Haliduola HN, Leutz S, Stroissnig H. Randomized, double-blind, multicenter study to evaluate efficacy, safety, tolerability, and immunogenicity between AVT04 and the reference product ustekinumab in patients with moderate-to-severe chronic plaque psoriasis. Expert Opin Biol Ther. 2023 Jul-Dec;23(8):759-771. doi: 10.1080/14712598.2023.2235263. Epub 2023 Jul 12. PMID: 37435850.
- Wynne C, Hamilton P, McLendon K, Stroissnig H, Smith M, Duijzings P, Ruffieux R, Otto H, Sattar A, Haliduola HN, Leutz S, Berti F. A randomized, double-blind, 3-arm, parallel study assessing the pharmacokinetics, safety, tolerability and immunogenicity of AVT04, an ustekinumab candidate biosimilar, in healthy adults. Expert Opin Investig Drugs. 2023 May;32(5):417-427. doi: 10.1080/13543784.2023.2215426. Epub 2023 May 23. PMID: 37212315.
- Feagan BG, Sandborn WJ, Gasink C, et al. Ustekinumab as Induction and Maintenance Therapy for Crohn's Disease. N Engl J Med. 2016;375(20):1946‐1960. doi:10.1056/NEJMoa1602773
- Sands BE, Sandborn WJ, Panaccione R, et al. Ustekinumab as Induction and Maintenance Therapy for Ulcerative Colitis. N Engl J Med. 2019;381(13):1201‐1214. doi:10.1056/NEJMoa1900750
- Gisbert JP, Chaparro M. Ustekinumab to treat Crohn's disease. Ustekinumab en el tratamiento de la enfermedad de Crohn. Gastroenterol Hepatol. 2017;40(10):688‐698. doi:10.1016/j.gastrohep.2017.08.006
- Lamb YN, Duggan ST. Ustekinumab: A Review in Moderate to Severe Crohn's Disease. Drugs. 2017;77(10):1105‐1114. doi:10.1007/s40265-017-0765-6
Liens :
- Lien vers Human medicine European public assessment report (EPAR)
- fiche médicament de l'ustekinumab sur le site du GETAID
- avis HAS sur WEZENLA : pas de données aux 07/11/24
- Meddispar : pas de données au 13/08/24
- CRAT pour le bioréférent STELARA
- IMGT-DB
Création de la fiche : Mathilde Glaziou
Dernière mise à jour : 11/24
Par :