Ustekinumab (STEQEYMA®) - Biosimilaire
Autre nom :
Structure : AcM humain, IgG1k
Cible : sous unité p40 de l'IL-12 et de l'IL-23
Code ATC : L04AC05
Forme galénique :
Solution injectable en seringue préremplie à 45 mg et 90 mg d'ustekinumab (disponible en ville).
Mode de production : Produit par une lignée cellulaire d’ovaire de hamster chinois en utilisant une technique d’ADN recombinant.
Mode d'administration : SC
Date de la première AMM : FDA xxx / EMA août 2024
Laboratoire : Celltrion Healthcare
Conservation : A conserver au réfrigérateur. Ne pas congeler. Les seringues préremplies individuelles peuvent être conservées à température ambiante jusqu'à 30 °C pendant une période unique de 31 jours maximum dans le carton d'origine à l'abri de la lumière. Une fois qu'une seringue a été conservée à température ambiante (jusqu'à 30 °C), elle ne doit pas être remise au réfrigérateur.
Indications :
- Psoriasis en plaques : traitement du psoriasis en plaques modéré à sévère chez l'adulte qui n'a pas répondu, ou qui présente une contre-indication, ou qui est intolérant aux autres traitements systémiques dont la ciclosporine, le méthotrexate (MTX) ou la puvathérapie (psoralène et UVA)
- Psoriasis en plaques de la population pédiatrique : traitement du psoriasis en plaques modéré à sévère chez l'enfant et l'adolescent âgé de 6 ans et plus, en cas d'échec à au moins 2 traitements et une forme étendue et/ou un retentissement psychosocial important.
- Rhumatisme psoriasique : est indiqué dans le traitement du rhumatisme psoriasique actif chez l'adulte lorsque la réponse à un précédent traitement de fond antirhumatismal non-biologique (DMARD) a été inadéquate
- Maladie de Crohn : traitement de la maladie de Crohn active modérée à sévère chez les patients adultes présentant une réponse insuffisante, une perte de réponse à un traitement conventionnel et d'au moins un anti-TNF, ou qui présentent une contre-indication médicale à ces traitements.
A noter que WEZENLA® n’a pas d’indication AMM dans la rectocolite hémorragique contrairement au STELARA®.
Prix indicatif (mars 2025): 1128,53 euros TTC la seringue préremplie.
Usage : Prescription réservée aux spécialistes en dermatologie, gastro-entérologie et hépatologie, médecine interne, rhumatologie. Disponible en ville.
Posologies :
Dose initial de 45 mg dans le psoriasis (chez l'enfant de + de 60 kg) et dans le rhumatisme psoriasique puis 45 mg 4 semaines plus tard. Les administrations suivantes ont lieu toutes les 12 semaines. La dose de 90 mg est utilisée chez les patients de plus de 100 kg.
Dans la maladie de Crohn, la dose est de 90 mg est administrée toutes les 12 semaines (parfois toutes les 8 semaines en cas d'échappement thérapeutique)
Mécanisme d'action :
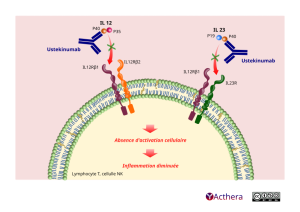
L’ustékinumab est un anticorps monoclonal IgG1κ entièrement humain qui se lie spécifiquement à la sous-unité protéique p40 commune aux cytokines humaines interleukine (IL)-12 et IL-23. L’ustékinumab inhibe la bioactivité de l’IL-12 et de l’IL-23 humaines en empêchant la p40 de se lier au récepteur protéique IL-12Rβ1 exprimé à la surface de cellules immunitaires. L’ustékinumab ne peut pas se lier à l’IL-12 ou à l’IL-23 si elles sont préalablement fixées à leurs récepteurs cellulaires de surface IL-12Rβ1. Il est donc peu probable que l’ustékinumab contribue à la cytotoxicité médiée par le complément ou par les anticorps des cellules comportant des récepteurs à l’IL-12 et/ou IL-23.
IL-12 et IL-23 sont des cytokines hétérodimériques sécrétées par des cellules présentatrices d’antigènes activées telles que les macrophages et les cellules dendritiques. Chacune des cytokines participe aux fonctions immunitaires ; l’IL-12 stimule les cellules natural killer (NK) et entraîne la différenciation des lymphocytes T CD4+ vers le phénotype T helper 1 (Th1), l’IL-23 induit la différenciation en lymphocyte T helper 17 (Th17). Cependant, une anomalie de la régulation des IL-12 et IL-23 a été associée à des maladies à médiation immunitaire, telles que le psoriasis, le rhumatisme psoriasique et la maladie de Crohn.
Effets indésirables les plus fréquents : Les effets indésirables les plus fréquents (> 5%) dans les phases contrôlées des études cliniques conduites avec l’ustekinumab chez les patients adultes atteints de psoriasis, de rhumatisme psoriasique, de la maladie de Crohn et de rectocolite hémorragique étaient des rhinopharyngites et des céphalées. La plupart ont été considérés comme étant légers et n’ont pas nécessité d’interruption du traitement étudié. Les effets indésirables les plus graves rapportés avec l’ustekinumab sont des réactions d’hypersensibilité graves incluant l’anaphylaxie .
Contre-indications : hypersensibilité à la substance active ou à l’un des excipients, patient avec infection active et cliniquement importante
Utilisation chez la femme enceinte :
Selon les RCP, les femmes en âge de procréer doivent utiliser une méthode de contraception efficace pendant le traitement et durant au moins 15 semaines après son arrêt.
Concernant l'aspect malformatif, les données publiées chez les femmes enceintes exposées à l’ustekinumab au 1er trimestre de la grossesse sont nombreuses et rassurantes. De plus, l’ustékinumab n’est pas tératogène chez le singe. Concernant l'aspect foetal et maternel, il y a un passage transplacentaire de l'ustékinumab à partir de 14 SA. Les données publiées chez les femmes enceintes exposées à l’ustékinumab au 2ème et/ou 3ème trimestres de la grossesse sont peu nombreuses, mais aucun effet fœtal ou néonatal particulier attribuable au traitement n’a été signalé à ce jour. Cependant, le nourrisson peut être exposé à un risque plus important d'infections.
Concernant l'allaitement, aucun événement particulier n’a été rapporté parmi une dizaine d’enfants allaités par des mères sous ustékinumab. C'est une molécule envisageable pendant l'allaitement.
Pharmacovigilance novembre 2022 : Le comité de pharmacovigilance (PRAC) de l'EMA recommande de ne pas administrer de vaccins vivants atténués aux nourrissons jusqu'à 6 mois s'ils ont été exposé à l'ustekinumab in utero (avertissement sur la notice). Cet immunosuppresseur a été détecté dans le sérum d'enfants exposés et le PRAC estime que le risque d'infection peut être plus important chez ces enfants.
Principales références :
Liens :
- Lien vers Human medicine European public assessment report (EPAR)
- fiche médicament de l'ustekinumab sur le site du GETAID
- avis HAS : pas de données au 03/03/25
- Meddispar : pas de données au 03/03/25
- Vidal
- CRAT pour l'ustekinumab
- IMGT-DB
Remarque :
Création de la fiche : Mars 2025
Par : Mathilde Glaziou
Dernière mise à jour : Mars 2025
Par : Mathilde Glaziou