Sarilumab (KEVZARA®)
Structure : AcM humain, IgG1k
Code ATC : L04AC14 (Antinéoplasiques et immunomodulateurs L04 Immunosuppresseurs L04A Immunosuppresseurs L04AC Inhibiteurs d'interleukine L04AC14 Sarilumab)
Nomenclature Ge : IgG1κ G1e0
Cible: IL-6Rα
Mode de production : Technologie de l'ADN recombinant dans des cellules ovariennes de hamster chinois (CHO).
Forme galénique : Seringues ou stylos préremplis de 150 mg et 200 mg.
Conservation : La durée de conservation du produit est de 3 ans. A conserver au réfrigérateur (entre 2°C et 8°C). Ne pas congeler. Une fois sorti du réfrigérateur, Kevzara doit être administré sous 14 jours et doit être conservé à une température ne dépassant pas 25 °C.
Mode d'administration : SC
Date de la première AMM : EMA juin 2017 / FDA mai 2017
Laboratoires : sanofi-aventis groupe
Indications : Kevzara est indiqué en association au méthotrexate chez les patients adultes atteints de polyarthrite rhumatoïde active modérée à sévère ayant eu une réponse inadéquate ou intolérants à un ou plusieurs traitements de fond (DMARD). Kevzara peut être utilisé en monothérapie en cas d'intolérance au MTX ou lorsque le traitement avec le MTX est inadapté.
Prix indicatif (juillet 2022) : 803,66 euros pour 2 seringues/stylos pré-remplis de 150 ou 200 mg.
Usage : Prescription initiale hospitalière. Le renouvellement de la prescription est réservé à certains spécialistes : médecine interne et rhumatologie. C'est un médicament d'exception, disponible à l'officine.
Posologies :
1 injection à 200 mg, toutes les 2 semaines.
En cas de neutropénie, de thrombopénie ou d'élévation des enzymes hépatiques, une réduction de la posologie de 200 mg toutes les 2 semaines à 150 mg toutes les 2 semaines est recommandée.
Le traitement par sarilumab doit être interrompu chez les patients qui développent une infection grave jusqu'à ce que l'infection soit contrôlée.
Si une dose de sarilumab est oubliée et que 3 jours ou moins se sont écoulés depuis l'oubli, la dose doit être administrée dès que possible. Si 4 jours ou plus se sont écoulés depuis l'oubli de la dose, la dose suivante doit être administrée à l'heure prévue.
Mécanisme d'action :
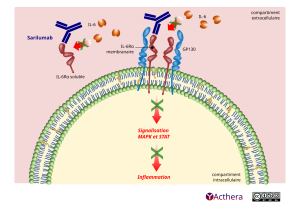
Le sarilumab est un anticorps monoclonal humain (de sous-type IgG1) qui se lie de manière spécifique aux récepteurs solubles et membranaires de l'IL-6 (IL-6 receptors, IL-6Rα) et inhibe la transmission du signal médié par les récepteurs de l'IL-6. Ce signal implique la glycoprotéine 130 (gp130), protéine ubiquitaire du signal de transduction, et STAT-3 (Signal Transducer And Activator of Transcription-3).
Dans des dosages effectués sur des cellules fonctionnelles humaines, le sarilumab a été capable de bloquer la voie de signalisation IL-6, mesuré par l'inhibition de STAT-3, seulement en présence d'IL-6.
L'IL-6 est une cytokine pléiotrope qui stimule des réponses cellulaires diverses telles que prolifération, différenciation, survie et apoptose, et peut activer les hépatocytes qui libèrent des protéines de phase aiguë de l'inflammation telles que la protéine C réactive (CRP) et le sérum amyloïde A. Des taux élevés d'IL-6 ont été retrouvés dans le liquide synovial des patients atteints de PR et jouent un rôle important à la fois dans l'inflammation et dans la destruction articulaire caractéristiques de la PR. L'IL-6 est impliquée dans divers processus physiologiques comme la migration et l'activation des cellules T, B, monocytes et ostéoclastes, entraînant une inflammation systémique, une inflammation synoviale et une érosion osseuse chez les patients atteints de PR.
L'action sur la réduction de l'inflammation du sarilumab est associée à des modifications des paramètres biologiques comme une réduction du NAN et une élévation des lipides (cf Mises en garde et Précautions d'emploi)
Effets indésirables les plus fréquents: Infection des voies aériennes supérieures, infection des voies urinaires, rhinopharyngite, herpès buccal, neutropénie, thrombopénie, hypercholestérolémie, hypertriglycéridémie, transaminases augmentées, érythème au site d'injection, prurit au site d'injection.
Contre-indications : Hypersensibilité à la substance active ou à l'un des excipients, infections sévères actives.
Utilisation chez la femme enceinte : Pas de données sur le CRAT : Il n'existe pas de données ou il existe des données limitées sur l'utilisation de sarilumab chez la femme enceinte. Les études effectuées chez l'animal n'ont pas montré d'effets nocifs directs ou indirects en matière de toxicité sur la reproduction.
Principales références :
Liens :
- fiche info de la base de données publique des médicaments
- IGMT
- HeTOP
- Vidal
Remarque :
Dernière mise à jour : Septembre 2022
Relecture par : Mathilde GLAZIOU