Glofitamab (COLUMVI®)
Autres noms : glofitamab-gxbm
Structure : AcM bispécifique humanisé de type IgG1 kappa lambda
Code ATC : L01FX28
Nomenclature Ge : xxx
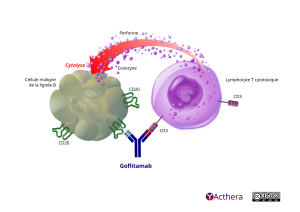
Cibles: CD20 et CD3 epsilon
Mode de production : Produit dans des cellules d’ovaire de hamster chinois (CHO) par la technologie de l’ADN recombinant
Forme galénique : solution à diluer pour perfusion
Mode d'administration : IV
Date de la première AMM : EMA juillet 2023 / FDA juin 2023
Laboratoires : Roche
Indications :
Ce biomédicament est indiqué en monothérapie pour le traitement des patients adultes atteints d’un lymphome diffus à grandes cellules B (LDGCB) réfractaire ou en rechute, après au moins deux lignes de traitement systémique.
Prix indicatif (année) : xxx
Usage : xxx
Posologies :
L’administration de Columvi commence par un schéma d’escalade de dose (destiné à réduire le risque de SRC) jusqu’à atteindre la dose recommandée de 30 mg, une fois que le prétraitement par obinutuzumab au Jour 1 du Cycle 1 est terminé. Chaque cycle dure 21 jours.
Mécanisme d'action :
Le glofitamab se lie de manière bivalente au CD20 exprimé à la surface des cellules B et de manière monovalente au CD3 exprimé à la surface des cellules T. En se liant simultanément au CD20 sur les cellules B et au CD3 sur la cellule T, le glofitamab induit la formation d’une synapse immunologique, entraînant une puissante activation et prolifération des cellules T, la sécrétion de cytokines et le relargage de protéines cytolytiques conduisant à la lyse des cellules B exprimant le CD20
Effets indésirables les plus fréquents : Le syndrome de relargage des cytokines, la neutropénie, l’anémie, la thrombopénie et le rash. (se référer au RCP pour avoir la liste complète des effets indésirables)
Contre-indications : Hypersensibilité à la substance active, à l’obinutuzumab, ou à l’un des excipients.
Principales références :
-
-
Liens :
- Human medicine European public assessment report (EPAR)
- HAS
- Base de données publique des médicaments
- ANSM
- Meddispar - pas de donnée au 11/07/24
- Vidal
- Centre de référence sur les agents tératogènes (CRAT) - pas de donnée au 11/07/24
Remarque :
Création de la fiche : Pr C. Carnoy
Dernière mise à jour : Juillet 2024
Relecture par : Mathilde Glaziou