Faricimab (VABYSMO®)
Autre nom : faricimab-svoa
Structure : AcM bispécifique humanisé de type IgG1
Code ATC : S01LA09
Nomenclature Ge : IgG1κλ G1e20
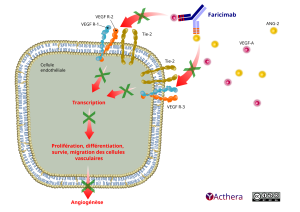
Cible: l’angiopoïétine-2 (Ang-2) et facteur de croissance de l’endothélium vasculaire A (VEGF-A)
Mode de production : produit en culture dans des cellules mammifères d’ovaires de hamster chinois (CHO) par la technologie de l’ADN recombinant
Forme galénique : Chaque flacon contient 28,8 mg de faricimab dans une solution de 0,24 mL. Cette quantité est suffisante pour permettre de délivrer une dose unique de 0,05 mL de solution contenant 6 mg de faricimab
Mode d'administration : injection intravitréenne
Date de la première AMM : EMA septembre 2022 / FDA janvier 2022
Laboratoire : Roche /Genentech
Indications : indiqué dans le traitement des patients adultes atteints de :
• dégénérescence maculaire liée à l’âge néovasculaire (humide) (DMLAn),
• la baisse d’acuité visuelle due à un oedème maculaire diabétique (OMD).
Prix indicatif (année) : XXX
Usage : Prescription réservée aux spécialistes en ophtalmologie.
Posologies :
La dose recommandée est de 6 mg (solution de 0,05 mL) administrée par injection intravitréenne toutes les 4 semaines pour les 4 premières doses.
Ensuite, une évaluation de l’activité de la maladie basée sur des résultats anatomiques et/ou visuels est recommandée 20 et/ou 24 semaines après l’initiation du traitement pour que le traitement puisse être individualisé. Chez les patients sans activité de la maladie, l’administration de faricimab toutes les 16 semaines (4 mois) doit être considéré. Chez les patients avec une activité de la maladie, un traitement toutes les 8 semaines (2 mois) ou toutes les 12 semaines (3 mois) doit être considéré. .
La dose recommandée est de 6 mg (solution de 0,05 mL) administrée toutes les 4 semaines pour les 4 premières doses.
Ensuite, le traitement est individualisé en utilisant une approche « treat-and-extend ». Sur avis du médecin en fonction des résultats anatomiques et/ou visuels des patients, l’intervalle des administrations peut être étendu jusqu’à 16 semaines (4 mois), par pallier allant jusqu’à 4 semaines. Si les résultats visuels et/ou anatomiques changent, l’intervalle de traitement devra être ajusté en conséquence, et une réduction de l’intervalle doit être mise en oeuvre si les résultats visuels et/ou anatomiques se détériorent. Les intervalles de traitement inférieurs à 4 semaines n’ont pas été étudiés.
Mécanisme d'action :
L’Ang-2 provoque une instabilité vasculaire en favorisant la déstabilisation endothéliale, la perte de péricytes et l’angiogenèse pathologique, potentialisant ainsi les fuites vasculaires et l’inflammation. Elle sensibilise également les vaisseaux sanguins à l’action du VEGF-A, ce qui entraîne une déstabilisation vasculaire supplémentaire. L’Ang-2 et le VEGF-A augmentent de manière synergique la perméabilité vasculaire et stimulent la néovascularisation. Par la double inhibition de l’Ang-2 et du VEGF-A, le faricimab réduit la perméabilité vasculaire et l’inflammation, inhibe l’angiogenèse pathologique et rétablit la stabilité vasculaire
Effets indésirables les plus fréquents : (se référer au RCP pour avoir la liste complète des effets indésirables)
- Les effets indésirables les plus fréquemment rapportés : cataracte (11 %), hémorragie conjonctivale (7 %), augmentation de la PIO (4 %), corps flottants vitréens (4 %), douleur oculaire (3 %) et déchirure de l’épithélium pigmentaire rétinien (DMLAn uniquement) (3 %).
- Les effets indésirables les plus graves : l’uvéite (0,5 %), la hyalite (0,3 %), l’endophtalmie (0,3 %), la déchirure de la rétine (0,2 %) et le décollement rhegmatogène de la rétine (< 0,1 %).
Contre-indications : Hypersensibilité à la substance active ou à l’un des excipients ; Infections oculaires ou périoculaires actives ou suspectées ; Inflammation intraoculaire active.
Principales références :
- Wykoff CC, Abreu F, Adamis AP, Basu K, Eichenbaum DA, Haskova Z, Lin H, Loewenstein A, Mohan S, Pearce IA, Sakamoto T, Schlottmann PG, Silverman D, Sun JK, Wells JA, Willis JR, Tadayoni R; YOSEMITE and RHINE Investigators. Efficacy, durability, and safety of intravitreal faricimab with extended dosing up to every 16 weeks in patients with diabetic macular oedema (YOSEMITE and RHINE): two randomised, double-masked, phase 3 trials. Lancet. 2022 Feb 19;399(10326):741-755. doi: 10.1016/S0140-6736(22)00018-6. Epub 2022 Jan 24. PMID: 35085503.
- Heier JS, Khanani AM, Quezada Ruiz C, Basu K, Ferrone PJ, Brittain C, Figueroa MS, Lin H, Holz FG, Patel V, Lai TYY, Silverman D, Regillo C, Swaminathan B, Viola F, Cheung CMG, Wong TY; TENAYA and LUCERNE Investigators. Efficacy, durability, and safety of intravitreal faricimab up to every 16 weeks for neovascular age-related macular degeneration (TENAYA and LUCERNE): two randomised, double-masked, phase 3, non-inferiority trials. Lancet. 2022 Feb 19;399(10326):729-740. doi: 10.1016/S0140-6736(22)00010-1. Epub 2022 Jan 24. PMID: 35085502.
- Nicolò M, Ferro Desideri L, Vagge A, Traverso CE. Faricimab: an investigational agent targeting the Tie-2/angiopoietin pathway and VEGF-A for the treatment of retinal diseases. Expert Opin Investig Drugs. 2021 Mar;30(3):193-200. doi: 10.1080/13543784.2021.1879791. Epub 2021 Feb 4. PMID: 33471572.
- Khan M, Aziz AA, Shafi NA, Abbas T, Khanani AM. Targeting Angiopoietin in Retinal Vascular Diseases: A Literature Review and Summary of Clinical Trials Involving Faricimab. Cells. 2020 Aug 10;9(8):1869. doi: 10.3390/cells9081869. PMID: 32785136; PMCID: PMC7464130.
Liens :
- Human medicine European public assessment report (EPAR)
- HAS (pas de données au 22/12/22)
- Base de données publique des médicaments (pas de données au 22/12/22)
- ANSM (pas de données au 22/12/22)
- Meddispar (pas de données au 22/12/22)
- Centre de référence sur les agents tératogènes (CRAT) (pas de données au 22/12/22)
Remarque :
Dernière mise à jour : 21/12/2022
Relecture par : Pr C. Carnoy