Amivantamab (RYBREVANT®)
Autre nom : amivantamab-vmjw
Structure : AcM bispécifique humain de type IgG1 kappa. Faible teneur en glucose.
Code ATC : L01FX18
Nomenclature Ge : xxx
Cible: EGFR & le facteur de transition mésenchymato-épithéliale (MET)
Mode de production : produit par une lignée cellulaire de mammifère (Ovaires de Hamster Chinois, CHO) à l’aide de la technologie de l’ADN recombinant
Forme galénique : Flacon de 7 mL de solution à diluer pour perfusion contenant 350 mg d’amivantamab
Mode d'administration : IV
Date de la première AMM : FDA 2021 / EMA décembre 2021
Laboratoires : Janssen-Cilag
Indications :
- en association au carboplatine et au pémétrexed, en première ligne de traitement des patients adultes atteints d’un cancer bronchique non à petites cellules (CBNPC) avancé avec mutations activatrices de l’EGFR par insertion dans l’exon 20.
- en monothérapie dans le traitement des patients adultes atteints d’un CBNPC avancé avec mutations activatrices de l’EGFR par insertion dans l’exon 20, après échec d'un traitement à base de sels de platine.
Prix indicatif (année) : XXX
Posologies : La posologie varie en fonction du poids (+ ou - de 80 kg). Lorsqu’il est utilisé en association au carboplatine et au pémétrexed, la dose de charge est injectée toutes les semaines pendant 4 semaines. Puis une dose d'entretien sera injectée 1X/3 semaines.
S'il est utilisé en monothérapie, la dose de charge est injectée toutes les semaines pendant 4 semaines. Puis une dose d'entretien sera injectée 1X/2 semaines.
En cas d'effets indésirables, un tableau de modification de dose est proposé directement dans les RCP.
Mécanisme d'action :
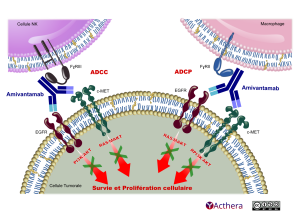
L’amivantamab cible les tumeurs présentant des mutations activatrices par insertion dans l’exon 20 de l’EGFR. L’amivantamab se lie aux domaines extracellulaires de l’EGFR et de MET. L’amivantamab perturbe les fonctions de signalisation de l’EGFR et de MET en bloquant la liaison du ligand et en accroissant la dégradation de l’EGFR et de MET, empêchant ainsi la croissance et la progression de la tumeur. La présence de l’EGFR et de MET à la surface des cellules tumorales permet également de cibler ces cellules pour une destruction par les cellules effectrices immunitaires telles que les cellules Natural Killer et les macrophages, via une cytotoxicité à médiation cellulaire dépendante des anticorps (ADCC) et des mécanismes de trogocytose, respectivement.
Diagramme montrant l'interaction entre l'anticorps Amivantamab et les récepteurs cellulaires. L’image se compose de trois éléments en haut à gauche, une cellule NK avec le récepteur FcγRIII. En haut à droite, un macrophage avec le récepteur FcγRII. En bas centrée une cellule tumorale avec les récepteurs EGFR et c-MET. Deux cas de figures sont représentés, à gauche ADCC à droite ADCP.
Situation ADCC amivantamab est en contact par sa chaîne légère avec FcγRIII, sa chaîne lourde de gauche e récepteur EGFR, la chaîne lourde de droite il touche le récepteur c-MET.
Situation ADCP la chaîne légère d’amivantamab est en contact avec FcγRII, la chaîne lourde de gauche avec le récepteur EGFR, la chaîne lourde de droite touche le récepteur c-MET.
L’amivantamab ainsi perturbe le signal envoyé par les récepteurs EGFR et c-MET présents sur la cellule tumorale. Amivantamab et les récepteurs sont internalisés et dégradés dans la cellule. Les processus Le blocage des signaux est matérialisé par des flèches rouge barrées d’une croix verte partant de l’EGFR annotées PI3K/AKT et deux depuis le c-MET légendées RAS/MAKT. Les quatres flèches rouges converge vers un texte écrit en rouge situé en bas de la cellule tumorale,"Survie et Prolifération cellulaire".
En bas à droite le logo "Acthera" et les mentions Creative Commons Licence 4 suivi des pictogrammes BY NC SA sont visibles.
Effets indésirables les plus fréquents : D’après les données sur l’amivantamab en monothérapie (N = 380), les effets indésirables les plus fréquents, tous grades confondus, étaient des rashs (76 %), des réactions liées à la perfusion (67 %), une toxicité pour les ongles (47 %), une hypoalbuminémie (31 %), des œdèmes (26 %), une fatigue (26 %), une stomatite (24 %), des nausées (23 %) et une constipation (23 %). Les effets indésirables graves incluaient des PID (1,3 %), des RLP (1,1 %) et des rashs (1,1 %). Trois pour cent des patients ont arrêté Rybrevant en raison d’effets indésirables. Les effets indésirables ayant le plus fréquemment conduit à un arrêt du traitement étaient les RLP (1,1 %), les PID (0,5 %), et une toxicité pour les ongles (0,5 %) (se référer au RCP pour avoir la liste complète des effets indésirables)
Contre-indications : Hypersensibilité à la substance active ou à l’un des excipients
Principales références :
-
-
-
-
Liens :
- Human medicine European public assessment report (EPAR)
- HAS
- Base de données publique des médicaments
- ANSM
- Meddispar (pas de données au 30 aout 2024)
- Vidal
- Centre de référence sur les agents tératogènes (CRAT) (pas de données au 30 aout 2024)
Remarque :
Création de la fiche : Pr C. Carnoy
Dernière mise à jour : 30 aout 2024
Relecture par :