Ustekinumab (STELARA®)
Structure : AcM humain, IgG1k
Cible : sous unité p40 de l'IL-12 et de l'IL-23
Code ATC : L04AC05
Forme galénique :
- flacon contenant 130 mg d'ustekinumab à diluer dans 26 mL (5 mg/mL).
- solution injectable à 45 mg / 0,5 ml d'ustekinumab,
- solution injectable en seringue préremplie à 45 mg (0,5 ml) et 90 mg (1 ml) d'ustekinumab,
Mode d'administration : SC
Date d'AMM : FDA 2009/ EMA 2009
Laboratoire : Janseen Cilag International NV
Indications :
Psoriasis en plaques : traitement du psoriasis en plaques modéré à sévère chez l'adulte qui n'a pas répondu, ou qui présente une contre-indication, ou qui est intolérant aux autres traitements systémiques dont la ciclosporine, le méthotrexate (MTX) ou la puvathérapie (psoralène et UVA) (voir rubrique Pharmacodynamie).
Psoriasis en plaques de la population pédiatrique : traitement du psoriasis en plaques modéré à sévère chez l'enfant et l'adolescent âgé de 6 ans et plus, en cas de réponse insuffisante ou d'intolérance aux autres traitements systémiques ou aux photothérapies (voir rubrique Pharmacodynamie).
Rhumatisme psoriasique : seul ou en association avec le méthotrexate (MTX), est indiqué dans le traitement du rhumatisme psoriasique actif chez l'adulte lorsque la réponse à un précédent traitement de fond antirhumatismal non-biologique (DMARD) a été inadéquate (voir rubrique Pharmacodynamie).
Maladie de Crohn : traitement de la maladie de Crohn active modérée à sévère chez les patients adultes présentant une réponse insuffisante, une perte de réponse ou une intolérance à un traitement conventionnel ou par anti-TNFα, ou qui présentent une contre-indication médicale à ces traitements.
Rectocolite hémorragique : traitement de la rectocolite hémorragique active modérée à sévère chez les patients adultes présentant une réponse insuffisante, une perte de réponse ou une intolérance à un traitement conventionnel ou à un agent biologique, ou qui présentent une contre-indication médicale à ces traitements.
Prix indicatif : 2310.71 € TTC la seringue préremplie à 45 mg / 0,5 ml (2020)
Usage : prescription initiale hospitalière d'une durée d'un an. Prescription réservée aux spécialistes en dermatologie, gastro-entérologie et hépatologie, médecine interne, rhumatologie.
Posologies : La dose initiale d'ustekinumab est de 45 mg suivie d'une dose de 45 mg 4 semaines plus tard, puis une dose de 45 mg toutes les 12 semaines
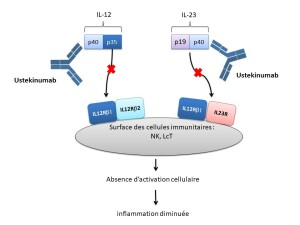
Mécanisme d'action :
Les épisodes inflammatoires observés dans le psoriasis et les MICI sont en partie liés à un trouble de régulation de l'IL-12 et de l'IL-23, deux cytokines pro-inflammatoires. L'ustékinumab, est dirigé contre la sous unité p40 commune à l'IL-12 et à l'IL-23. L'ustékinumab empêche la fixation de ces interleukines au récepteur IL-12Rβ1 présent à la surface des cellules immunitaires, limitant ainsi l'activation des cellules NK, des LT CD4+.
Effets indésirables les plus fréquents: infection dentaire, infection des voies respiratoires
Contre-indications : hypersensibilité au médicament, patient avec infection active
Principales références :
- Références bibliographiques :
Feagan BG, Sandborn WJ, Gasink C, et al. Ustekinumab as Induction and Maintenance Therapy for Crohn's Disease. N Engl J Med. 2016;375(20):1946‐1960. doi:10.1056/NEJMoa1602773
Sands BE, Sandborn WJ, Panaccione R, et al. Ustekinumab as Induction and Maintenance Therapy for Ulcerative Colitis. N Engl J Med. 2019;381(13):1201‐1214. doi:10.1056/NEJMoa1900750
Gisbert JP, Chaparro M. Ustekinumab to treat Crohn's disease. Ustekinumab en el tratamiento de la enfermedad de Crohn. Gastroenterol Hepatol. 2017;40(10):688‐698. doi:10.1016/j.gastrohep.2017.08.006
Lamb YN, Duggan ST. Ustekinumab: A Review in Moderate to Severe Crohn's Disease. Drugs. 2017;77(10):1105‐1114. doi:10.1007/s40265-017-0765-6
Jeon C, Sekhon S, Yan D, Afifi L, Nakamura M, Bhutani T. Monoclonal antibodies inhibiting IL-12, -23, and -17 for the treatment of psoriasis. Hum Vaccin Immunother. 2017;13(10):2247‐2259. doi:10.1080/21645515.2017.1356498
- fiche médicament de l'ustekinumab sur le site du GETAID
- Avis de la HAS sur Stelara
- Lien vers Human medicine European public assessment report (EPAR)