Trastuzumab emtansine (KADCYLA®)
Structure : AcM humanisé, IgG1k conjugué au DM1 dérivé de la
Code ATC : L01XC14
Nomenclature Ge : IgG1κ G1e0 conjuguée
Cible: ErbB-2 = HER-2 (human epidermal growth factor receptor-2)
Mode d'administration : IV
Forme galénique : Poudre (100 mg ou 160 mg) pour solution à diluer pour perfusion
Date de la première AMM : EMA 2013 / FDA 2013
Laboratoires : Roche / Genentech Inc
Indications : cancer du sein métastatique HER2 positif ou localement avancé non résécable chez des patients ayant reçu au préalable du trastuzumab et un taxane, séparément ou en association.
Prix indicatif :
Usage : réservé à l'usage hospitalier
Posologies : 3,6 mg/kg de poids corporel toutes les 3 semaines
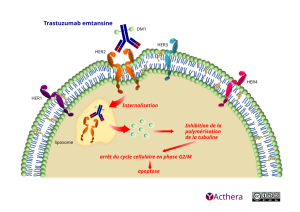
Mécanisme d'action :
Le trastuzumab emtansine est un anticorps monoclonal conjugué qui contient le trastuzumab lié de façon covalente à un cytotoxique dérivé de la maytansine appelé DM1. Ce composé chimique est un inhibiteur de microtubules libéré de manière intracellulaire, permettant de bloquer le cycle cellulaire des cellules surexprimant HER2, ce qui induit leur apoptose. En moyenne, 3,5 molécules de DM1 sont conjuguées à chaque molécule de trastuzumab.
Effets indésirables les plus fréquents: infections urinaires, thrombocytopénie, hypokaliémie, insomnie, hémorragie, céphalées, douleurs abdominales
Contre-indications : hypersensibilité au médicament
Principales références :
- (LoRusso et al., 2011) , (Verma et al., 2012)
- Lien vers Human medicine European public assessment report (EPAR)
- Avis de la HAS sur Kadcyla
- Fiche info de Kadcyla de la base de données publique des médicaments
- IMGT