Tislelizumab (TEVIMBRA®)
Autre nom : tislelizumab-jsgr
Structure : AcM humanisé de type IgG4 kappa avec fragment Fc modifié
Code ATC : L01FF09
Nomenclature Ge : xxx
Cible: PD-1
Mode de production : produit dans des cellules ovariennes de hamster chinois par la technologie de l’ADN recombinant
Forme galénique : Solution à diluer pour perfusion. Chaque flacon de 10 mL contient 100 mg de tislelizumab (100 mg/10 mL)
Mode d'administration : IV
Date de la première AMM : EMA septembre 2023 / FDA 2024
Laboratoire : BeiGene Ireland Ltd
Indications :
Cancer bronchique non à petites cellules (CBNPC)
Tevimbra, en association à une chimiothérapie à base de pémétrexed et de sel de platine, est indiqué dans le traitement de 3e ligne des patients adultes atteints d’un CBNPC non épidermoïde dont les tumeurs expriment PD-L1 dans ≥ 50 % des cellules tumorales, sans mutations de l’EGFR ou de l’ALK, lorsque :
• le CBNPC est localement avancé, non résécable, et que les patients ne peuvent pas recevoir une radiochimiothérapie concomitante à base de sels de platine, ou
• le CBNPC est métastatique. Tevimbra, en association avec le carboplatine et le paclitaxel ou le nab-paclitaxel, est indiqué dans le traitement de première ligne des patients adultes atteints d’un CBNPC épidermoïde, lorsque :
• le CBNPC est localement avancé, non résécable, et que les patients ne peuvent pas recevoir une radiochimiothérapie concomitante à base de sels de platine, ou
• le CBNPC est métastatique.
Tevimbra en monothérapie est indiqué dans le traitement des patients adultes atteints d’un CBNPC, localement avancé ou métastatique, après une chimiothérapie à base de sels de platine antérieure. Les patients atteints d’un CBNPC présentant une mutation de l’EGFR ou ALK+ doivent également avoir reçu une thérapie ciblée avant de recevoir le tislélizumab.
Carcinome épidermoïde de l’œsophage (CEO)
Tevimbra en monothérapie est indiqué dans le traitement des patients adultes atteints d’un CEO localement avancé non résécable ou métastatique, après une chimiothérapie antérieure à base de sels de platine.
Prix indicatif (année) : XXX
Usage : réservé à l'usage hospitalier ou en clinique sous la supervision d’un médecin expérimenté.
Posologies : dose de 200 mg toutes les 3 semaines associée ou non à une chimiothérapie
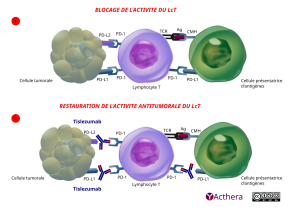
Mécanisme d'action :
Le tislelizumab est dirigé contre PD-1, se liant au domaine extracellulaire du récepteur PD-1 humain. Il bloque de manière compétitive la liaison des ligands PD-L1 et PD-L2, inhibant ainsi la voie de signalisation négative médiée par PD-1 et améliorant l’activité fonctionnelle des lymphocytes T dans les tests in vitro.
Effets indésirables les plus fréquents : Les effets indésirables le plus fréquent étaient l’anémie (29,2 %), la fatigue (22,9 %) et l’augmentation du taux d’aspartate aminotransférase (20,9 %). Les effets indésirables de grade 3/4 les plus fréquents étaient l’anémie (5,0 %), la pneumonie (4,2 %), l’hyponatrémie (2,7 %), l’augmentation du taux d’aspartate aminotransférase (2,6 %), l’augmentation du taux sanguin de bilirubine (2,0 %), la pneumopathie inflammatoire (2,0 %) et la fatigue (2,0 %).
Chez 1,27 % des patients, la survenue d’effets indésirables a entraîné le décès. Les effets indésirables ayant entraîné le décès étaient la pneumonie (0,78 %), l’hépatite (0,13 %), la pneumopathie inflammatoire (0,07 %), la dyspnée (0,07 %), la diminution de l’appétit (0,07 %) et la thrombocytopénie (0,07 %). (se référer au RCP pour avoir la liste complète des effets indésirables)
Contre-indications : Hypersensibilité à la substance active ou à l’un des excipients
Principales références :
- Yang Y, Pan J, Wang H, Zhao Y, Qu S, Chen N, Chen X, Sun Y, He X, Hu C, Lin L, Yu Q, Wang S, Wang G, Lei F, Wen J, Yang K, Lin Z, Guo Y, Chen S, Huang X, Wu Y, Liang L, Chen C, Bai F, Ma X, Zhang Y, Leaw S, Zhang L, Fang W. Tislelizumab plus chemotherapy as first-line treatment for recurrent or metastatic nasopharyngeal cancer: A multicenter phase 3 trial (RATIONALE-309). Cancer Cell. 2023 Jun 12;41(6):1061-1072.e4. doi: 10.1016/j.ccell.2023.04.014. Epub 2023 May 18. PMID: 37207654.
- Shen L, Kato K, Kim SB, Ajani JA, Zhao K, He Z, Yu X, Shu Y, Luo Q, Wang J, Chen Z, Niu Z, Zhang L, Yi T, Sun JM, Chen J, Yu G, Lin CY, Hara H, Bi Q, Satoh T, Pazo-Cid R, Arkenau HT, Borg C, Lordick F, Li L, Ding N, Tao A, Shi J, Van Cutsem E; RATIONALE-302 Investigators. Tislelizumab Versus Chemotherapy as Second-Line Treatment for Advanced or Metastatic Esophageal Squamous Cell Carcinoma (RATIONALE-302): A Randomized Phase III Study. J Clin Oncol. 2022 Sep 10;40(26):3065-3076. doi: 10.1200/JCO.21.01926. Epub 2022 Apr 20. Erratum in: J Clin Oncol. 2024 Feb 1;42(4):486. doi: 10.1200/JCO.23.02629. PMID: 35442766; PMCID: PMC9462531.
- Zhang L, Geng Z, Hao B, Geng Q. Tislelizumab: A Modified Anti-tumor Programmed Death Receptor 1 Antibody. Cancer Control. 2022 Jan-Dec;29:10732748221111296. doi: 10.1177/10732748221111296. PMID: 35926155; PMCID: PMC9358212.
- Lee A, Keam SJ. Tislelizumab: First Approval. Drugs. 2020 Apr;80(6):617-624. doi: 10.1007/s40265-020-01286-z. PMID: 32185681.
Liens :
- Human medicine European public assessment report (EPAR)
- HAS
- Base de données publique des médicaments : pas de données au 29 décembre 2024
- ANSM
- Meddispar : pas de données au 29 décembre 2024
- Vidal : pas de données au 29 décembre 2024
- Centre de référence sur les agents tératogènes (CRAT) : pas de données au 29 décembre 2024
Remarque :
Création de la fiche : Pr C. Carnoy
Dernière mise à jour : 29 décembre 2024
Relecture par :