Tildrakizumab (ILUMETRI®)
Autre nom : ILUMYA® (USA)
Structure : AcM humanisé, IgG1k
Code ATC : L04AC17
Cible: IL-23 p19
Mode de production : produit par des cellules ovariennes de hamster chinois (CHO) par la technique de l'ADN recombinant
Forme galénique : ILUMETRI 100 mg S inj en seringue préremplie Ser/1ml
Mode d'administration : SC
Date d'AMM : FDA mars 2018 / EMA septembre 2018
Laboratoires : SunPharma
Indications : Ilumetri est indiqué dans le traitement du psoriasis en plaques modéré à sévère chez l'adulte qui nécessite un traitement systémique.
Prix indicatif : 2401,77 euros (1 seringue préremplie)
Usage : Prescription initiale hospitalière annuelle, renouvellement service dermatologie/médecine interne
Posologies : La dose recommandée d'Ilumetri est de 100 mg administrée par injection sous-cutanée, administrée aux semaines 0 et 4, puis toutes les 12 semaines
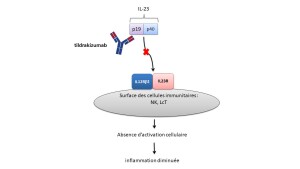
Mécanisme d'action :
Le tildrakizumab se lie de manière spécifique à la sous-unité protéique p19 de la cytokine interleukine-23 (IL-23), sans se lier à l'IL-12, et inhibe son interaction avec le récepteur de l'IL-23. L'IL-23 est une cytokine naturellement produite, impliquée dans les réponses inflammatoire et immunitaire. Le tildrakizumab inhibe la libération des cytokines pro-inflammatoires et des chimiokines.
Effets indésirables les plus fréquents: Infections des voies respiratoires supérieures y compris rhinopharingyte
Contre-indications : Hypersensibilités, Infections évolutives et cliniquement grave (par exemple tuberculose active)
Principales références :
- Résumé des caractéristiques produit (EMA) [pdf][1]
- Lien vers Human medicine European public assessment report (EPAR)
- Lien vers la fiche info de la base de données publique des médicaments
- IMGT
- HeTOP
Remarque :
Dernière mise à jour : Novembre 2021
Relecture par : Dr Emmanuel Hermann