Serplulimab (HETRONIFLY®)
Structure : AcM humanisé de type IgG4 kappa avec une modification de la séquence stabilisatrice dans la région charnière
Code ATC : L01FF12
Nomenclature Ge : xxx
Cible: PD-1
Mode de production : Produit dans des cellules ovariennes de hamster chinois par la technologie de l'ADN recombinant
Forme galénique : Flacon de 10 mL de solution à diluer contenant 100 mg de serplulimab (10 mg/mL).
Mode d'administration : IV
Date de la première AMM : EMA février 2025 / FDA XXX
Laboratoire : Accord Healthcare S.L.U.
Indications : indiqué en association avec le carboplatine et l'étoposide dans le traitement de première intention des patients adultes atteints d'un cancer du poumon à petites cellules de stade étendu (CPPC-SE)
Prix indicatif (année) : XXX
Posologies : La dose recommandée est de 4,5 mg/kg de poids corporel de serplulimab toutes les 3 semaines jusqu'à progression de la maladie ou toxicité inacceptable
Mécanisme d'action :
Le serplulimab se lie au récepteur de la mort cellulaire programmée 1 (PD-1) et bloque son interaction avec les ligands PD-L1 et PD-L2. Le récepteur PD-1 est un régulateur négatif de l'activité des cellules T dont l'implication dans le contrôle des réponses immunitaires des cellules T a été démontrée. L'engagement de PD-1 avec les ligands PD-L1 et PD-L2, qui sont exprimés dans les cellules présentatrices d'antigènes et peuvent être exprimés par les tumeurs ou d'autres cellules du microenvironnement tumoral, entraîne l'inhibition de la prolifération des cellules T et de la sécrétion de cytokines. Le serplulimab potentialise les réponses des cellules T, y compris les réponses antitumorales, en bloquant la liaison de PD-1 aux ligands PD-L1 et PD-L2.
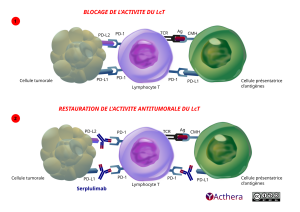
Schema 1 : sans l’AcM. Le schéma du haut intitulé BLOCAGE DE L’ACTIVITÉ DU LcT en lettres rouges, nous montre trois cellules côte à côte. A gauche une cellule tumorale verte et boursouflée, au centre de l’illustration un Lymphocyte T bleu violet et à droite une « cellule présentatrice d'antigènes » (CPA) verte qui interagit avec la cellule du centre violette située à sa gauche intitulée lymphocyte « Lymphocyte T ». La cellule tumorale possède deux ligands, un PD-L2 (violet dégradé bleu) en haut et un PD-L1 (bleu) en bas. Ces ligands sont en contact avec deux récepteurs PD-1 (bleu) présents à gauche sur la surface du Lymphocyte T. Sur le côté droit du Lymphocyte T en bas un récepteur PD-1 accueille un ligand PD-L1 qui est en surface la CPA. En haut à la surface de la CPA un CMH (gris) est en contact avec un Ag. Cet Ag (rouge foncé) est aussi en contact à sa gauche avec un récepteur TCR (noir) présent à la surface du Lymphocyte T.
Schéma 2 : avec serplulimab. Sur le schéma du bas, intitulé "RESTAURATION DE L'ACTIVITÉ ANTITUMORALE DU LcT" écrit en lettres capitales rouges. Serplulimab en bleu (AcM humanisé IgG4 représenté en bleu avec 3 traits rouges sur les chaînes lourdes) se glisse entre les ligands PD-L2 (en haut) et PD-L1 (en bas) issus de la cellule tumorale et les deux récepteurs PD-1 (bleu) face à eux sur le lymphocyte T. A droite à la surface du Lymphocyte T le serplulimab empêche le récepteur PD-1 (bleu gris) au centre de l’image, d’être en contact le ligand PD-L1 située à sa droite sur la CPA. L’empêchement des ces contacts permet la restauration de l’activité antitumorale du Lymphocyte T.
A droite en bas figure le logo Acthera à sa droite les pictogrames Creative Commons Licence BY NC SA.
Effets indésirables les plus fréquents : Les effets indésirables les plus fréquemment observés sont la neutropénie (82,8%), la leucopénie (74,0%), l'anémie (72,8%), la thrombocytopénie (56,0%), l'alopécie (54,2%), les nausées (36,2%), l'hyperlipidémie (32,1%), la diminution de l'appétit (28,3%), l'hypoprotéinémie (25,4%) et l'hyponatrémie (25,4%) (se référer au RCP pour avoir la liste complète des effets indésirables)
Contre-indications : Hypersensibilité à la substance active ou à l'un des excipients
Principales références :
- Shen P, Zhang T, Hao L, Jing M, Wu Y, Yu S. Efficacy and safety of serplulimab in solid tumors: a meta-analysis. Front Pharmacol. 2025 Jun 18;16:1604874. doi: 10.3389/fphar.2025.1604874. PMID: 40606609; PMCID: PMC12213645.
- Shi M, Yang W, Zhou Y, Xia X, Zhou M, Zhou X, Wang J. First-line serplulimab-based immunochemotherapy in elderly patients with extensive-stage small cell lung cancer: a multicenter, real-world study. J Thorac Dis. 2025 May 30;17(5):3157-3169. doi: 10.21037/jtd-24-1815. Epub 2025 May 27. PMID: 40529764; PMCID: PMC12170144.
- Cheng Y, Han L, Wu L, Chen J, Sun H, Wen G, Ji Y, Dvorkin M, Shi J, Pan Z, Shi J, Wang X, Bai Y, Melkadze T, Pan Y, Min X, Viguro M, Li X, Zhao Y, Yang J, Makharadze T, Arkania E, Kang W, Wang Q, Zhu J; ASTRUM-005 Study Group. Effect of First-Line Serplulimab vs Placebo Added to Chemotherapy on Survival in Patients With Extensive-Stage Small Cell Lung Cancer: The ASTRUM-005 Randomized Clinical Trial. JAMA. 2022 Sep 27;328(12):1223-1232. doi: 10.1001/jama.2022.16464. PMID: 36166026; PMCID: PMC9516323.
- Song Y, Zhang B, Xin D, Kou X, Tan Z, Zhang S, Sun M, Zhou J, Fan M, Zhang M, Song Y, Li S, Yuan Y, Zhuang W, Zhang J, Zhang L, Jiang H, Gu K, Ye H, Ke Y, Li J, Wang Q, Zhu J, Huang J; ASTRUM-007 investigators. First-line serplulimab or placebo plus chemotherapy in PD-L1-positive esophageal squamous cell carcinoma: a randomized, double-blind phase 3 trial. Nat Med. 2023 Feb;29(2):473-482. doi: 10.1038/s41591-022-02179-2. Epub 2023 Feb 2. PMID: 36732627; PMCID: PMC9941045.
Liens :
- Human medicine European public assessment report (EPAR)
- HAS (pas de données au 7 aout 2025)
- Base de données publique des médicaments (pas de données au 7 aout 2025)
- ANSM (pas de données au 7 aout 2025)
- Meddispar (pas de données au 7 aout 2025)
- Vidal (pas de données au 7 aout 2025)
- Centre de référence sur les agents tératogènes (CRAT) (pas de données au 7 aout 2025)
Remarque :
Création de la fiche : Pr C. Carnoy
Dernière mise à jour : 22 aout 2025
Relecture par :