Ranibizumab (RANIVISIO®) - Biosimilaire
Structure : fragment Fab issu d'un AcM humanisé, IgG1k
Code ATC : S01LA04
Nomenclature Ge : IgG1κ G1e6
Cible: VEGF (vascular endothelial growth factor)
Mode de production : produit dans des cellules d'Escherichia coli par la technologie de l'ADN recombinant
Forme galénique : Flacon contenant 2,3 mg de ranibizumab dans 0,23 ml de solution (10 mg/ml). Cette quantité est suffisante pour permettre de délivrer une dose unique de 0,05 ml contenant 0,5 mg de ranibizumab aux patients adultes
Mode d'administration : injection intravitréenne
Conservation : Au réfrigérateur entre 2 et 8°C, dans son emballage d'origine fermé. Après sorti du réfrigérateur, le produit se conserve 24h à température ambiante (max 25°C)
Date de la première AMM : FDA xxx / EMA aout 2022
Laboratoires : Midas Pharma GmbH
Indications :
- Le traitement de la forme néovasculaire (humide) de la dégénérescence maculaire liée à l'âge (DMLA).
- Le traitement de la baisse visuelle due à l’oedème maculaire diabétique (OMD).
- Le traitement de la rétinopathie diabétique proliférante (RDP)
- Le traitement de la baisse visuelle due à l’oedème maculaire secondaire à une occlusion de branche veineuse rétinienne (OBVR) ou de la veine centrale de la rétine (OVCR)
- Le traitement de la baisse visuelle due à une néovascularisation choroïdienne (NVC).
Prix indicatif : 325.62 € le flacon de 0,23 ml (2,3 mg)
Usage : réservé aux spécialistes en ophtalmologie. Depuis l'arrêté du 31/10/24, le ranibizumab fait partie du groupe biologique similaire pouvant donner lieu à une substitution par le pharmacien d'officine.
Posologies : La dose recommandée chez les adultes est de 0,5 mg, administrée en une injection intravitréenne unique de 0,05 ml. L’intervalle entre deux doses injectées dans le même oeil doit être d’au moins quatre semaines. Le traitement chez les adultes sera initié avec une injection par mois jusqu’à ce que l’acuité visuelle maximale soit atteinte et/ou jusqu’à l’absence de signe d’activité de la maladie, c’est-à-dire pas de changement de l’acuité visuelle ni des autres signes et symptômes de la maladie sous traitement continu.
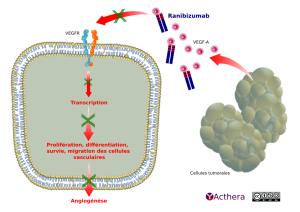
Mécanisme d'action :
Le ranibizumab se lie avec une haute affinité aux isoformes du VEGF-A (p. ex. VEGF110, VEGF121 et VEGF165), empêchant dès lors la liaison du VEGF-A à ses récepteurs VEGFR-1 et VEGFR-2. La liaison du VEGF-A à ses récepteurs induit une prolifération des cellules endothéliales et une néovascularisation ainsi qu’une perméabilité vasculaire, tous ces facteurs étant considérés comme contribuant à la progression de la forme néovasculaire de la dégénérescence maculaire liée à l’âge, de la myopie forte et des néovascularisations choroïdiennes (NVC) ou à la baisse de vision due soit à un oedème maculaire diabétique soit à un oedème maculaire secondaire à l’occlusion veineuse rétinienne (OVR) chez les adultes
Effets indésirables les plus fréquents : La majorité des effets indésirables rapportés après l’administration de ranibizumab sont liés à la procédure d’injection intravitréenne.
- Les effets indésirables oculaires les plus fréquemment rapportés après l’injection de ranibizumab sont : des douleurs oculaires, des hyperhémies oculaires, des augmentations de la pression intraoculaire, des hyalites, des décollements du vitré, des hémorragies rétiniennes, des troubles visuels, des corps flottants vitréens, des hémorragies conjonctivales, des irritations oculaires, des sensations de corps étranger dans l’oeil, des sécrétions lacrymales accrues, des blépharites, des sécheresses oculaires et des prurits oculaires.
- Les effets indésirables non oculaires les plus fréquemment rapportés sont des céphalées, des rhino-pharyngites et des arthralgies.
Contre-indications : hypersensibilité au médicament, patient présentant une infection oculaire ou périoculaire active ou suspectée ou présentant une inflammation intraoculaire active sévère
Principales références :
- Woo SJ, Veith M, Hamouz J, Ernest J, Zalewski D, Studnicka J, Vajas A, Papp A, Gabor V, Luu J, Matuskova V, Yoon YH, Pregun T, Kim T, Shin D, Bressler NM. Efficacy and Safety of a Proposed Ranibizumab Biosimilar Product vs a Reference Ranibizumab Product for Patients With Neovascular Age-Related Macular Degeneration: A Randomized Clinical Trial. JAMA Ophthalmol. 2021 Jan 1;139(1):68-76. doi: 10.1001/jamaophthalmol.2020.5053. PMID: 33211076; PMCID: PMC7677876.
- Parravano M, Costanzo E, Scondotto G, Trifirò G, Virgili G. Anti-VEGF and Other Novel Therapies for Neovascular Age-Related Macular Degeneration: An Update. BioDrugs. 2021 Nov;35(6):673-692. doi: 10.1007/s40259-021-00499-2. Epub 2021 Oct 16. PMID: 34655434.
- Rosenfeld PJ, Brown DM, Heier JS, Boyer DS, Kaiser PK, Chung CY, Kim RY; MARINA Study Group. Ranibizumab for neovascular age-related macular degeneration. N Engl J Med. 2006 Oct 5;355(14):1419-31. doi: 10.1056/NEJMoa054481. PMID: 17021318.
Liens :
- Human medicine European public assessment report (EPAR)
- HAS
- Avis de la HAS sur la place dans la stratégie thérapeutique de LUCENTIS, EYLEA et de leurs comparateurs cliniquement pertinents dans la forme néovasculaire (humide) de la DMLA
- Base de données publique des médicaments (Données pour le Lucentis ; pas de données pour le Ranivisio au 23 mars 2023)
- ANSM
- Meddispar (Données pour le Lucentis ; pas de données pour le Ranivisio au 23 mars 2023)
- Centre de référence sur les agents tératogènes (CRAT)
- HeTOP[2]
Remarque :
Création de la fiche : Pr C. Carnoy
Dernière mise à jour : 12/24
Relecture par : Mathilde Glaziou