Ranibizumab (LUCENTIS®) - Bioréférent
Structure : fragment Fab issu d'un AcM humanisé, IgG1k
Code ATC : S01LA04
Nomenclature Ge : IgG1κ G1e6
Cible: VEGF (vascular endothelial growth factor)
Mode de production : produit dans des cellules d'Escherichia coli par la technologie de l'ADN recombinant
Forme galénique : seringue préremplie de solution injectable à 10 mg/10 mL (flacons de 2,3 mg).
Mode d'administration : injection intravitréenne
Conservation : au réfrigérateur entre 2 et 8°C, dans son emballage fermé dans la boîte d'origine à l'abri de la lumière. Avant l'utilisation, l'emballage scellé pourra être conservé à température ambiante (ne dépassant pas 25 °C) jusqu'à 24 heures.
Date de la première AMM : EMA 2007 / FDA 2006
Laboratoires : Genentech Inc / Novartis Pharmaceuticals Corp.
Indications :
- Dégénérescence maculaire liée à l'âge (DMLA)
- Néovascularisation choroïdienne (NVC)
diabétique (OMD)
secondaire à une occlusion de branche veineuse rétinienne (OBVR) ou de la veine centrale de la rétine (OVCR)
- Rétinopathie diabétique proliférante (RDP)
- Chez les prématurés, dans le traitement de la rétinopathie du prématuré (RP)
Prix indicatif :
2023 : 541,25 euros la seringue préremplie à 10mg/mL
2020 : 603.9 € la seringue préremplie à 10 mg/mL
2013 : 819,35€ le flacon de 2,3 mg
Usage : Prescription réservée aux spécialistes en ophtalmologie. Médicament d'exception, disponible en ville. Depuis l'arrêté du 31/10/24, le ranibizumab fait partie du groupe biologique similaire pouvant donner lieu à une substitution par le pharmacien d'officine.
Posologies :
- Chez l'adulte ; 0,5 mg/mois (soit 0,05 mL) en injection intravitréenne, poursuivi jusqu'à ce que l'acuité visuelle soit maximale.
- Pour les prématurés ; 0,2 mg (soit 0,02 mL)
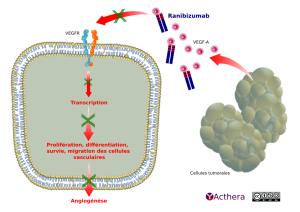
Mécanisme d'action :
La liaison du VEGF-A à ses récepteurs induit une prolifération et une néovascularisation des cellules endothéliales ainsi qu'une perméabilité vasculaire, favorisant la progression de la DMLA ou la baisse de vision due, soit à un œdème maculaire diabétique, soit à un œdème maculaire secondaire à une occlusion des veines rétiniennes. Le ranibizumab est un fragment d'anticorps monoclonal humanisé dirigé contre le VEGF-A qui empêche la liaison du VEGF-A à ses récepteurs VEGFR-1 et VEGFR-2.
Effets indésirables les plus fréquents : céphalées, rhinopharyngite, infections des voies urinaires, anémies, affections hématologiques et lymphatiques, EI liés à la procédure d'injection intra-vitréenne (hyalite, décollement du vitré, hémorragies rétinienne...), arthralgies.
Contre-indications : Hypersensibilité au médicament, patient avec infection ou inflammation oculaire.
Utilisation chez la femme enceinte : Selon le CRAT, les données publiées chez les femmes enceintes exposées au ranibizumab en cours de grossesse sont très peu nombreuses, mais aucun effet malformatif, foetotoxique ou néonatal n’a été signalé à ce jour. Le ranibizumab n'est pas non plus tératogène chez le singe. Le passage placentaire parait négligeable car les immunoglobulines passent le placenta en utilisant un récepteur fixant leur fragment Fc et le ranibizumab en est dépourvu.
Principales références :
- Nguyen et al., 2012 ; Bandello et al., 2011
Liens :
- Avis de la HAS sur Lucentis
- Avis de la HAS sur la place dans la stratégie thérapeutique de LUCENTIS, EYLEA et de leurs comparateurs cliniquement pertinents dans la forme néovasculaire (humide) de la DMLA
- Lien vers Human medicine European public assessment report (EPAR)
- IMGT/DB
- Lien vers le site de la FDA
- Lien vers la fiche info de la base de données publique des médicaments
- ANSM
- CRAT
- Vidal
- HeTop
Remarque :
Dernière mise à jour : 12/24
Par : Mathilde GLAZIOU