Ranibizumab (LUCENTIS®)
Structure : fragment Fab issu d'un AcM humanisé, IgG1k
Cible: VEGF (vascular endothelial growth factor)
Mode de production : produit dans des cellules d'Escherichia coli par la technologie de l'ADN recombinant
Forme galénique : seringue préremplie avec 0,165 ml (1,65 mg)
Mode d'administration : injection intravitréenne
Date d'AMM : FDA 2006 / EMA 2007
Laboratoires : Genentech Inc / Novartis Pharmaceuticals Corp.
Indications : dégénérescence maculaire liée à l'âge (DMLA). néovascularisation choroïdienne (NVC), oedème maculaire diabétique (OMD), oedème maculaire secondaire à une occlusion de branche veineuse rétinienne (OBVR) ou de la veine centrale de la rétine (OVCR)
Prix indicatif :
2020 : 603.9 € la seringue préremplie à 10 mg / ml soit 1,65 mg de ranibizumab pour 0,165 ml
2013 : 819,35€ le flacon de 2,3 mg
Usage : réservé aux spécialistes en ophtalmologie
Posologies : 0,5 mg/mois en injection intravitréenne, poursuivi jusqu'à ce que l'acuité visuelle soit maximale
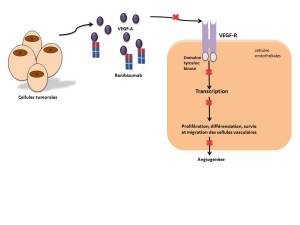
Mécanisme d'action :
La liaison du VEGF-A à ses récepteurs induit une prolifération et une néovascularisation des cellules endothéliales ainsi qu'une perméabilité vasculaire, favorisant la progression de la DMLA ou la baisse de vision due, soit à un œdème maculaire diabétique, soit à un œdème maculaire secondaire à une occlusion des veines rétiniennes. Le ranibizumab est un fragment d'anticorps monoclonal humanisé dirigé contre le VEGF-A qui empêche la liaison du VEGF-A à ses récepteurs VEGFR-1 et VEGFR-2.
Effets indésirables les plus fréquents: céphalées, rhinopharyngite
Contre-indications : hypersensibilité au médicament, patient avec infection ou inflammation oculaire
Principales références :
- Nguyen et al., 2012 ; Bandello et al., 2011
- Avis de la HAS sur Lucentis
- Avis de la HAS sur la place dans la stratégie thérapeutique de LUCENTIS, EYLEA et de leurs comparateurs cliniquement pertinents dans la forme néovasculaire (humide) de la DMLA
- Lien vers Human medicine European public assessment report (EPAR)
- Lien vers la fiche info de la base de données publique des médicaments