Omalizumab (XOLAIR®)
Structure : AcM humanisé, IgG1k
Code ATC : R03DX05
Nomenclature Ge : IgG1κ G1e0
Cible: Immunoglobuline de type E (IgE)
Code ATC : R03DX05
Mode de production : Technique de l'ADN recombinant sur une lignée cellulaire ovarienne de hamster chinois
Forme galénique : Seringue préremplie de 0,5 ml (75mg) ou de 1ml (150mg)
Mode d'administration : SC
Date de la première AMM : FDA 2003 / EMA 2005
Laboratoires : Genentech Inc / Novartis Pharmaceuticals Corp/ Tanox Inc
Indications :
Le traitement par Xolair ne doit être envisagé que chez les patients présentant un asthme dont la dépendance aux IgE a été établie .
Adultes et adolescents (à partir de 12 ans) :
Xolair est indiqué, en traitement additionnel, pour améliorer le contrôle de l'asthme chez les patients atteints d'asthme allergique persistant sévère, ayant un test cutané positif ou une réactivité in vitro à un pneumallergène perannuel et qui, malgré un traitement quotidien par un corticoïde inhalé à forte dose et un bêta-2-agoniste inhalé à longue durée d'action, présentent une réduction de la fonction pulmonaire (VEMS < 80 % de la valeur théorique), des symptômes diurnes ou des réveils nocturnes fréquents, et des exacerbations sévères, multiples et documentées de l'asthme.
Enfants (de 6 ans à moins de 12 ans) :
Xolair est indiqué, en traitement additionnel, pour améliorer le contrôle de l'asthme chez les patients atteints d'asthme allergique persistant sévère, ayant un test cutané positif ou une réactivité in vitro à un pneumallergène perannuel et qui, malgré un traitement quotidien par un corticoïde inhalé à forte dose et un bêta-2-agoniste inhalé à longue durée d'action, présentent des symptômes diurnes ou des réveils nocturnes fréquents, et des exacerbations sévères, multiples et documentées de l'asthme.
Xolair est indiqué, en traitement additionnel aux corticoïdes intranasaux, dans le traitement de la polypose naso-sinusienne sévère chez les adultes (à partir de 18 ans) insuffisamment contrôlés par les corticoïdes intranasaux.
Urticaire chronique spontanée :
Xolair est indiqué, en traitement additionnel, dans le traitement de l'urticaire chronique spontanée chez les adultes et adolescents (à partir de 12 ans) présentant une réponse insuffisante aux traitements antihistaminiques anti-H1.
Prix indicatif 2021 : 168.36 € (1 seringue de 0,5 ml, 75 mg) (178,76 euros en 2019) ; 335,58 euros (1 seringue de 1 ml, 150 mg) (355,94 euros en 2019)
Usage : prescription initiale hospitalière annuelle, Prescription initiale et renouvellement réservés aux spécialistes en pneumologie, en pédiatrie ou en oto-rhino-laryngologie
Posologies :
Asthme allergique et de polypose naso-sinusienne :
La dose et la fréquence d'administration sont déterminées en fonction du taux initial d'IgE (UI/ml), mesuré avant le début du traitement, et du poids corporel (kg). En fonction de ces mesures, une dose de 75 à 600mg de Xolair en 1 à 4 injections pourra être nécessaire lors de chaque administration. La dose maximale recommandée est de 600mg d’omalizumab toutes les deux semaines.
Urticaire chronique spontanée : Xolair 150 mg
La dose recommandée est de 300 mg en injection sous-cutanée toutes les 4 semaines.
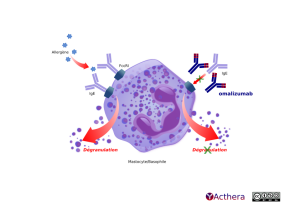
Mécanisme d'action :
Effets indésirables les plus fréquents:
Chez l’adulte et l’adolescent : maux de tête, des étourdissements, des arthralgies, des douleurs abdominales hautes et réactions au site d'injection.
Chez les enfants : céphalées, fièvre et douleurs abdominales hautes
Contre-indications : hypersensibilité à la substance active ou à l'un des excipients
Principales références :
- Pelaia C, Calabrese C, Terracciano R, de Blasio F, Vatrella A, Pelaia G. Omalizumab, the first available antibody for biological treatment of severe asthma: more than a decade of real-life effectiveness. Ther Adv Respir Dis. 2018 Jan-Dec;12:1753466618810192. doi: 10.1177/1753466618810192. PMID: 30400762; PMCID: PMC6236630.
- Bousquet J, Humbert M, Gibson PG, Kostikas K, Jaumont X, Pfister P, Nissen F. Real-World Effectiveness of Omalizumab in Severe Allergic Asthma: A Meta-Analysis of Observational Studies. J Allergy Clin Immunol Pract. 2021 Jul;9(7):2702-2714. doi: 10.1016/j.jaip.2021.01.011. Epub 2021 Jan 21. PMID: 33486142.
- Gevaert P, Omachi TA, Corren J, Mullol J, Han J, Lee SE, Kaufman D, Ligueros-Saylan M, Howard M, Zhu R, Owen R, Wong K, Islam L, Bachert C. Efficacy and safety of omalizumab in nasal polyposis: 2 randomized phase 3 trials. J Allergy Clin Immunol. 2020 Sep;146(3):595-605. doi: 10.1016/j.jaci.2020.05.032. Epub 2020 Jun 7. Erratum in: J Allergy Clin Immunol. 2021 Jan;147(1):416. PMID: 32524991.
- Tiotiu A, Oster JP, Roux PR, Nguyen Thi PL, Peiffer G, Bonniaud P, Dalphin JC, de Blay F. Effectiveness of Omalizumab in Severe Allergic Asthma and Nasal Polyposis: A Real-Life Study. J Investig Allergol Clin Immunol. 2020;30(1):49-57. doi: 10.18176/jiaci.0391. Epub 2019 Apr 1. PMID: 30931917.
Lien :
- Human medicine European public assessment report (EPAR)
- Avis de la HAS sur Xolair
- Base de données publique des médicaments
- IMGT
- HeTOP
Remarque :
Dernière mise à jour : 23/07/2021
Relecture par : Dr P. De Nadaï