Natalizumab (TYSABRI®)
Ancien nom : Antegren®
Structure : AcM humanisé, IgG4
Cible: chaîne α de l'intégrine α4β1 (VLA-4) , ligand de VCAM1
Mode d'administration : IV
Date d'AMM : FDA 2004 / EMA 2006. Après 3 cas de LEMP mortels, le natalizumab est retiré du marché le 28 Février 2005. Face à la demande des associations de patients, la FDA décide de remettre le médicament sur le marché en 2006.
Laboratoires : Biogen IDEC pharmaceuticals / Elan pharmaceuticals international Ltd.
Indications : Sclérose en plaques forme récurrente-rémittente après échec des traitements initiaux, maladie de Crohn (FDA 2008)
Prix indicatif : 1800€ pour 300 mg de natalizumab (2013)
Usage : réservé à l'usage hospitalier
Posologies : Pour la sclérose en plaques et la maladie de Crohn : 300 mg 1 fois toutes les 4 semaines
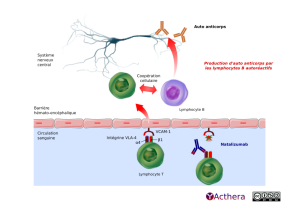
Mécanisme d'action :
Le natalizumab est un anticorps monoclonal qui se fixe à la sous-unité α4 de l'intégrine α4β1 (VLA-4) présente à la surface des LcT. L'intégrine α4β1 se fixe sur la molécule d'adhésion VCAM présente sur les cellules endothéliales de la barrière hémato-encéphalique (BHE). L'interaction VCAM/intégrine VLA-4 facilite le passage des LcT à travers la BHE. Le natalizumab bloque ainsi le passage des LcT exprimant l'intégrine α4 à travers la BHE. Cela a pour conséquence de diminuer l'inflammation au niveau du SNC et notamment de limiter l'action des LcB responsables de la production d'auto-anticorps.
Effets indésirables les plus fréquents: infection urinaire, urticaire, céphalées
Contre-indications : hypersensibilité au médicament, leucoencéphalopathie multifocale progressive, patients présentant un risque accru d'infections opportunistes, y compris patients immunodéprimés
Principales références :
- Cervera, 2012 ; Goodin et al., 2008 ; Kudick et al., 2013
- Avis de la HAS sur Tysabri
- Lien vers Human medicine European public assessment report (EPAR)