Ibritumomab (ZEVALIN®)
Structure : AcM murin IgG1k couplé à l'Yttrium 90
Cible: CD20
Mode d'administration : IV
Date d'AMM : FDA 2002 / EMA 2004
Laboratoires : Biogen IDEC Pharmaceuticals (Cambridge MA USA) Schering AG (Berlin Germany)
Indications : traitement du lymphome non hodgkinien CD20 positifs
Prix indicatif 2012 :
Usage : réservé à l'usage hospitalier
Posologies : selon le taux de plaquettes. Si la numération plaquettaire est supérieure ou égale à 150 000/mm3, 15 MBq de Zevalin par kg de poids, si la numération plaquettaire est comprise entre 100 000 et 149 000 par mm3, 11 MBq de Zevalin
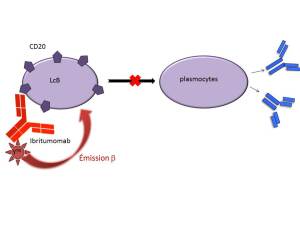
Mécanisme d'action :
L'ibritumomab permet, grâce au radioisotope de tuer les cellules cibles et les cellules cancéreuses à proximité grâce à un rayonnement ß ainsi que par le mécanisme d'ADCC. Ce mécanisme limite la prolifération des lymphocytes B. Il est préférable d'administrer au préalable le rituximab (AcM anti CD20) pour éliminer les lymphocytes B circulants afin de permettre à l'anticorps monoclonal radioactif d'irradier plus spécifiquement les lymphocytes B lymphomateux
Effets indésirables les plus fréquents: neutropénie, leucocytopénie, thrombopénie, anémie, nausées, asthénie
Contre-indications : hypersensibilité au médicament, grossesse et allaitement
Principales références :
- (Morschhauser et al., 2008), (Witzig et al., 2002
- Avis de la HAS du Zevalin
- Lien vers Human medicine European public assessment report (EPAR)