Enfortumab vedotin (PADCEV®)
Autres noms : enfortumab vedotin-ejfv
Structure : IgG1 kappa humain, conjugué à un agent de perturbation des microtubules, la monométhylauristatine E (MMAE), via un agent de liaison sensible au clivage protéolytique, la maléimidocaproyle valine-citrulline
Code ATC : L01FX13
Nomenclature Ge : IgG1κ G1e0 conjuguée
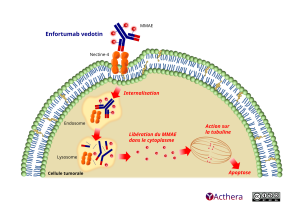
Cible: nectine-4
Mode de production : xx
Forme galénique : poudre pour solution à diluer pour perfusion
Mode d'administration : IV
Date de la première AMM : EMA Avril 2022 / FDA juillet 2021
Laboratoire : Astellas Pharma
Indications : indiqué en monothérapie pour le traitement des patients adultes atteints de carcinome urothélial localement avancé ou métastatique, ayant reçu précédemment une chimiothérapie à base de sels de platine et un inhibiteur du récepteur de mort programmée-1 ou un inhibiteur du ligand du récepteur de mort programmée-1.
Prix indicatif (année) : xxx
Usage : Médicament réservé à l'usage hospitalier. Prescription réservée aux spécialistes en oncologie ou aux médecins compétents en cancérologie. Médicament nécessitant une surveillance particulière pendant le traitement.
Posologies : La dose recommandée d'enfortumab vedotin est de 1,25 mg/kg (jusqu'à 125 mg maximum pour les patients ≥ 100 kg) administrée par perfusion intraveineuse pendant 30 minutes aux jours 1, 8 et 15 d'un cycle de 28 jours, jusqu'à la progression de la maladie ou la survenue d'une toxicité inacceptable.
Mécanisme d'action :
L'enfortumab vedotin est un conjugué anticorps-médicament (ADC) ciblant la nectine-4, une protéine d'adhésion située à la surface des cellules urothéliales cancéreuses. Les données non cliniques suggèrent que l'activité anticancéreuse de l'enfortumab vedotin résulte de la liaison de l'ADC aux cellules exprimant la nectine-4, suivie par l'internalisation du complexe ADC-nectine-4, et la libération de la MMAE par clivage protéolytique. La libération de la MMAE déstabilise le réseau de microtubules au sein de la cellule, entraînant ainsi l'arrêt du cycle cellulaire et la mort cellulaire par apoptose. La MMAE libérée par les cellules ciblées par l'enfortumab vedotin peut se diffuser dans les cellules voisines à faible expression de nectine-4, causant ainsi la mort cellulaire.
Effets indésirables les plus fréquents : Alopécie (48,8 %), fatigue (46,8 %), diminution de l’appétit (44,9 %), neuropathie périphérique sensitive (38,7 %), diarrhée (37,6 %), nausée (36 %), prurit (33,4 %), dysgueusie (29,9 %), anémie (26,5 %), perte de poids (23,4 %), éruption maculo-papuleuse (22,9 %), sécheresse cutanée (21,6 %), vomissement (18,4 %), augmentation du taux d’aspartate aminotransférase (15,3 %), hyperglycémie (13,1 %), sécheresse oculaire (12,8 %), augmentation du taux d’alanine aminotransférase (12,1 %) et éruption cutanée (10,4 %) (se référer au RCP pour avoir la liste complète des effets indésirables)
Contre-indications : Hypersensibilité à la substance active ou à l’un des excipients
Principales références :
-
-
-
-
Liens :
- Human medicine European public assessment report (EPAR)
- HAS
- Base de données publique des médicaments
- ANSM
- Meddispar - pas de données au 11/07/24
- Centre de référence sur les agents tératogènes (CRAT) - pas de données au 11/07/24
Remarque :
Dernière mise à jour : juillet 2024
Relecture par : Mathilde Glaziou