Dostarlimab (JEMPERLI®)
Autre nom : dostarlimab-gxly
Structure : IgG4 kappa humanisé
Code ATC : L01XC40 ou L01FF07
Nomenclature Ge : IgG4κ G4e1
Cible: programmed cell death protein-1 (PD-1)
Mode de production : produit par la technique de l’ADN recombinant dans des cellules de mammifères, d’ovaire de hamster chinois (CHO)
Forme galénique : flacon de 10 mL de solution à diluer pour perfusion contenant 500 mg de dostarlimab.
Mode d'administration : IV (en perfusion de 30 min)
Conservation : Le flacon se conserve au réfrigérateur entre 2 et 8 °C, non ouvert, pendant une durée de 30 mois. Une fois diluée, en cas d’utilisation non immédiate, la stabilité physico-chimique a été démontrée pendant une durée de 24 heures à une température comprise entre 2 °C et 8 °C, et pendant 6 heures à température ambiante (ne dépassant pas 25 °C) entre le moment de la préparation/dilution et la fin de l’administration.
Date de la première AMM : FDA avril 2021 / EMA Avril 2021
Laboratoires : GlaxoSmithKline
Indication :
- En monothérapie pour le traitement des patientes adultes atteintes d’un cancer de l’endomètre, récidivant ou avancé, qui présente une déficience du système de réparation des mésappariements des bases (dMMR)/une instabilité microsatellitaire élevée (MSI-H), en progression après ou pendant une chimiothérapie à base de platine
- En association avec le carboplatine et le paclitaxel pour le traitement des patients adultes atteints d'un cancer de l'endomètre (CE) primaire avancé ou récidivant présentant un défaut de réparation des mésappariements (dMMR)/une instabilité des microsatellites élevée
Prix indicatif (année) : XXX
Usage : Médicament nécessitant une surveillance particulière pendant le traitement. Prescription réservée aux spécialistes en cancérologie ou en oncologie médicale. Réservé à l'usage HOSPITALIER.
Posologies :
- La dose recommandée en monothérapie est de 500 mg de dostarlimab toutes les 3 semaines pour les 4 premiers cycles, puis de 1 000 mg toutes les 6 semaines pour tous les cycles suivants.
- La dose recommandée en association est de 500 mg de dostarlimab toutes les 3 semaines en association avec le carboplatine et le paclitaxel toutes les 3 semaines pendant 6 cycles, puis 1000 mg de dostarlimab en monothérapie toutes les 6 semaines pour tous les cycles suivants.
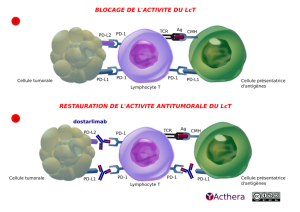
Mécanisme d'action :
Dostarlimab se lie aux récepteurs PD-1 et bloque la liaison à ses ligands PD-L1 et PD-L2. L’inhibition de la réponse immunitaire médiée par la voie PD-1 entraîne l’inhibition de la fonction des cellules T telle que la prolifération, la production de cytokines et l’activité cytotoxique. Dostarlimab potentialise la réponse des cellules T, dont les réponses immunitaires anti-tumorales via le blocage de la liaison du récepteur PD-1 à ses ligands PD-L1 et PDL2. Dans des modèles tumoraux chez la souris, le blocage de l’activité du récepteur PD-1 a entraîné une diminution de la croissance tumorale
Effets indésirables les plus fréquents : Chez les patients qui présentaient des tumeurs solides avancées ou récidivantes (Etude GARNET ; N = 515), les effets indésirables les plus fréquents (> 10%) étaient : anémie (25,6%), nausées (25,0%), diarrhées (22,5%), vomissements (18,4%), arthralgie (13,8%), prurit (11,5%), éruption cutanée (11,1%), fièvre (10,5%) et hypothyroïdie (10,1%). JEMPERLI a été arrêté définitivement chez 17 patientes (3,3 %) en raison d’effets indésirables, la plupart d’origine immunologique. Les effets indésirables étaient graves chez 8,7% des patients ; les effets indésirables les plus graves étaient les effets indésirables d’origine immunologiques (se référer au RCP pour avoir la liste complète des effets indésirables).
Contre-indications : Hypersensibilité à la substance active ou à l’un des excipients
Temps d'élimination : La t1/2 à l’état d’équilibre est de 25,4 jours.
Utilisation pendant la grossesse : L’administration de dostarlimab chez la femme en âge de procréer comporte un risque. Les femmes en âge de procréer doivent utiliser une méthode de contraception efficace pendant le traitement par dostarlimab et jusqu’à 4 mois après l’administration de la dernière dose de dostarlimab. Les données sur l’utilisation de dostarlimab chez la femme enceinte sont limitées. D’après son mode d’action, l’administration de dostarlimab pendant la grossesse peut causer des effets pharmacologiques délétères sur le fœtus (augmentation du risque de rejet).
Principales références :
- Markham A. Dostarlimab: First Approval. Drugs. 2021 Jul;81(10):1213-1219. doi: 10.1007/s40265-021-01539-5. PMID: 34106455.
- Oaknin A, Gilbert L, Tinker AV, Brown J, Mathews C, Press J, Sabatier R, O'Malley DM, Samouelian V, Boni V, Duska L, Ghamande S, Ghatage P, Kristeleit R, Leath C III, Guo W, Im E, Zildjian S, Han X, Duan T, Veneris J, Pothuri B. Safety and antitumor activity of dostarlimab in patients with advanced or recurrent DNA mismatch repair deficient/microsatellite instability-high (dMMR/MSI-H) or proficient/stable (MMRp/MSS) endometrial cancer: interim results from GARNET-a phase I, single-arm study. J Immunother Cancer. 2022 Jan;10(1):e003777. doi: 10.1136/jitc-2021-003777. PMID: 35064011; PMCID: PMC8785197.
- Passiglia F, Bironzo P, Righi L, Listì A, Arizio F, Novello S, Volante M, Scagliotti GV. A Prospective Phase II Single-arm Study of Niraparib Plus Dostarlimab in Patients With Advanced Non-small-cell Lung Cancer and/or Malignant Pleural Mesothelioma, Positive for PD-L1 Expression and Germline or Somatic Mutations in the DNA Repair Genes: Rationale and Study Design. Clin Lung Cancer. 2021 Jan;22(1):e63-e66. doi: 10.1016/j.cllc.2020.07.014. Epub 2020 Aug 5. PMID: 32917522.
- Musacchio L, Salutari V, Pignata S, Braicu E, Cibula D, Colombo N, Frenel JS, Zagouri F, Carbone V, Ghizzoni V, Giolitto S, Giudice E, Perri MT, Ricci C, Scambia G, Lorusso D. Randomized phase III trial on niraparib-TSR-042 (dostarlimab) versus physician's choice chemotherapy in recurrent ovarian, fallopian tube, or primary peritoneal cancer patients not candidate for platinum retreatment: NItCHE trial (MITO 33). Int J Gynecol Cancer. 2021 Oct;31(10):1369-1373. doi: 10.1136/ijgc-2021-002593. PMID: 34607820.
Liens :
- Human medicine European public assessment report (EPAR)
- HAS
- Base de données publique des médicaments
- ANSM
- Meddispar (pas disponible au 19/01/24)
- Centre de référence sur les agents tératogènes (CRAT) (pas disponible au 19/01/24)
- HeTOP[2]
Remarque :
Dernière mise à jour : janvier 2024
Relecture par : Mathilde GLAZIOU