Dinutuximab beta (QARZIBA®)
Ancien nom : APEIRON®
Autre nom : UNITUXIN (USA) ; ch14.18
Structure : AcM chimérique, IgG1k
Nomenclature Ge : IgG1κ G1e0
Cible: disialoganglioside 2 (GD2)
Mode d'administration : IV
Date de la première AMM : FDA 2015 / EMA 2017
Laboratoires : APEIRON Biologics AG
Indications : Neuroblastome à haut risque
Prix indicatif :
Usage : milieu hospitalier
Posologies :
Le traitement par Dinutuximab beta Apeiron s'effectue en 5 cycles consécutifs, chaque cycle comprend 35 jours. La dose individuelle est déterminée sur la base de la surface corporelle et doit atteindre un total de 100 mg/m² par cycle.
Il peut être administré de deux manières:
au moyen d'une perfusion continue durant les 10 premiers jours de chaque cycle (240 heures au total) à une dose de 10 mg/m² par jour
ou par 5 perfusions quotidiennes de 20 mg/m² administrées sur une durée de 8 heures durant les 5 premiers jours de chaque cycle.
Mécanisme d'action :
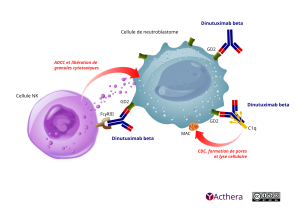
Le dinutuximab bêta réagit spécifiquement avec les groupements carbohydrates du disialoganglioside 2 (GD2), qui est fortement exprimé à la surface des cellules de neuroblastomes. Le dinutuximab bêta entraine une cytotoxicité dépendante du complément (CDC) et une cytotoxicité à médiation cellulaire dépendante des anticorps (ADCC) sur lignées cellulaires de neuroblastomes. De plus, les études in vivo ont démontré que le dinutuximab bêta pouvait éliminer les métastases hépatiques dans un modèle de foie syngénique chez la souris. La neurotoxicité associée au dinutuximab bêta est probablement due à l'induction d'une allodynie mécanique pouvant être provoquée par la réaction du dinutuximab bêta avec l'antigène GD2 situé à la surface des fibres nerveuses périphériques et de la gaine de myéline.
(MAC = membrane attack complex = complexe d'attaque membranaire)
Effets indésirables les plus fréquents: fièvre, la douleur, l'hypersensibilité, les vomissements, diarrhée, syndrome de fuite capillaire, hypotension
Contre-indications :
Principales références :
- Lien vers Human medicine European public assessment report (EPAR)
- Avis de la HAS sur Dinutuximab