Cemiplimab (LIBTAYO®)
Structure : IgG4 humain
Code ATC : L01XC33
Nomenclature Ge : IgG4κ G4e1
Cible: PD-1 (récepteur de mort cellulaire programmé-1)
Mode de production : Le cémiplimab est produit par technologie de l’ADN recombinant dans des cellules ovariennes de hamster chinois (cellules CHO) en culture en suspension.
Forme galénique : Flacon de 350 mg de cémiplimab dans une solution de 7 ml, solution à diluer pour perfusion.
Mode d'administration : IV
Conservation : Une fois le flacon ouvert, le médicament devra être dilué et perfusé immédiatement. Si la solution diluée n'est pas administrée immédiatement, elle peut être temporairement conservée :
à une température ambiante ne dépassant pas 25 °C pendant 8 heures maximum à compter de l'heure de la préparation de la perfusion jusqu'à la fin de la perfusion.
au réfrigérateur, entre 2 °C et 8 °C pendant 24 heures maximum à compter de l'heure de préparation de la perfusion jusqu'à la fin de la perfusion. Ne pas congeler. Laissez la solution diluée revenir à température ambiante avant administration.
Date de la première AMM : FDA 2018 - EMA juin 2019
Laboratoires et lien vers LIBTAYO® : Sanofi-aventis France
Indications :
- Carcinome épidermoïde cutané : en monothérapie pour le traitement de patients adultes atteints d'un carcinome épidermoïde cutané métastatique ou localement avancé qui ne sont pas candidats à une chirurgie curative ni à une radiothérapie curative
- Carcinome basocellulaire : en monothérapie pour le traitement de patients adultes atteints d’un carcinome basocellulaire localement avancé ou métastatique (CBCla ou CBCm) ayant progressé ou présentant une intolérance à un inhibiteur de la voie Hedgehog (IHH)
- Carcinome bronchopulmonaire non à petites cellules : En monothérapie pour le traitement de première ligne de patients adultes atteints d’un cancer bronchopulmonaire non à petites cellules (CBNPC) exprimant PD-L1 (dans ≥ 50 % des cellules tumorales) sans altérations du gène EGFR, ALK ou ROS1.
En monothérapie pour le traitement de patientes adultes atteintes d’un cancer du col de l’utérus récidivant ou métastatique et présentant une progression de la maladie pendant ou après une chimiothérapie à base de platine.
Chez les patientes atteintes d'un cancer du col de l'utérus récidivant ou métastatique et ayant une progression de la maladie pendant ou après une chimiothérapie à base de platine sans que celle-ci ait été associée au pembrolizumab.
Usage : Médicament réservé à l’usage hospitalier. Prescription réservée aux spécialistes en oncologie ou aux médecins compétents en cancérologie. Non disponible en ville.
Posologies : 350 mg administré toutes les 3 semaines par perfusion intraveineuse de 30 minutes.
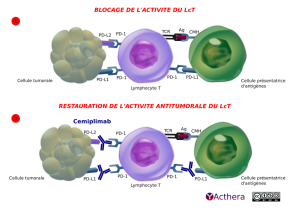
Mécanisme d'action :
Le cémiplimab se lie au récepteur de mort cellulaire programmé-1 (PD-1) et bloque son interaction avec ses ligands PD-L1 et PD-L2. L'engagement de PD-1 avec ses ligands PD-L1 et PD-L2, qui sont exprimés par des cellules présentatrices d'antigène et qui peuvent être exprimés par des cellules tumorales et / ou d'autres cellules du microenvironnement tumoral, entraîne une inhibition de la fonction des cellules T, telle que la prolifération, la sécrétion de cytokines et l'activité cytotoxique. Le cémiplimab potentialise les réponses des cellules T, y compris les réponses anti-tumorales, en bloquant la liaison de PD-1 aux ligands PD-L1 et PD-L2.
Effets indésirables les plus fréquents : Infections, anémie, réactions au point d'injection, diminution d'appétit, troubles digestifs, éruptions cutanées.
Contre-indications : Hypersensibilité à la substance.
Utilisation chez la femme enceinte : Les femmes en âge de procréer doivent utiliser une contraception efficace pendant le traitement par le cémiplimab et au moins 4 mois après la dernière dose de cémiplimab. Aucune étude sur la reproduction animale n’a été menée avec le cémiplimab. On ne dispose d’aucune donnée sur l’utilisation du cémiplimab chez la femme enceinte. Les études effectuées chez l’animal ont démontré que l’inhibition de la voie PD-1/PD-L1 peut augmenter le risque de rejet immunologique du fœtus en développement et ainsi la mort du fœtus.
Principales références :
Ahmed SR, Petersen E, Patel R, Migden MR. Cemiplimab-rwlc as first and only treatment for advanced cutaneous squamous cell carcinoma. Expert Rev Clin Pharmacol. 2019;12(10):947–951. doi:10.1080/17512433.2019.1665026
Migden MR, Rischin D, Schmults CD, et al. PD-1 Blockade with Cemiplimab in Advanced Cutaneous Squamous-Cell Carcinoma. N Engl J Med. 2018;379(4):341–351. doi:10.1056/NEJMoa1805131
Liens :
- Avis de la HAS sur LIBTAYO®
- Vidal : article de février 2021
- IMGT/DB
Remarque :
Dernière mise à jour : Janvier 2024
Par : Mathilde GLAZIOU