Catumaxomab (REMOVAB®)
Attention :
Catumaxomab a été le premier AcM bispécifique mis sur le marché dans le traitement des ascites malignes. La commercialisation du catumaxomab a été interrompue en 2014 et l'autorisation été retirée en Europe en Juin 2017 à la requête de Neovil Biotech GmbH.
AcM hybride rat/souris, IgG2
Code ATC : L01XC09
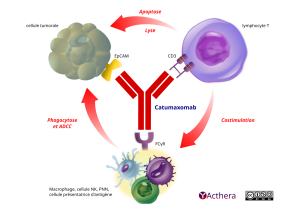
Cible : CD3 et EpCAM
Mode d'administration : voie intrapéritonéale
Date de la première AMM : FDA 2009 / EMA 2009
Laboratoires : Fresenius Biotec GmbH
Indications : ascite maligne chez les patients atteints de carcinomes EpCAM–positifs
Prix indicatif:
Usage : réservé à l'usage hospitalier
Posologies : Quatre perfusions intrapéritonéales : 10 µg au J0, 20 µg J3, 50 µg J7 et 150 µg au J10
Mécanisme d'action : ennew7m4123
Le catumaxomab est un anticorps composé de 2 paratopes distincts : le premier reconnaît un épitope sur la molécule EpCAM et le second se fixe sur le CD3, marqueur des lymphocytes T. EpCAM est une molécule d'adhérence des cellules épithéliales. Le catumaxomab peut également se fixer sur des cellules immunitaires via le FcgR permettant ainsi aux LcT, aux cellules tumorales et aux cellules cytotoxiques d'être à proximité les unes des autres, permettant ainsi la mort des cellules tumorales par ADCC, CDC.
Effets indésirables les plus fréquents: nausées, vomissements, pyrexie, fatigue, frissons
Contre-indications : hypersensibilité au médicament
Principales références : (Seimetz D et al., 2011), (Heiss et al., 2010)
- Lien vers Human medicine European public assessment report (EPAR)