Burosumab (CRYSVITA®)
Autre nom : burosumab-twza
Structure : AcM humain, IgG1
Code ATC : M05BX05
Nomenclature Ge : IgG1κ G1e0
Cible: FGF23
Mode de production : Produit par la technologie de l’ADN recombinant en culture de cellules de mammifère (cellules d’ovaire de hamster chinois, CHO)
Forme galénique : Solution injectable en flacon
Mode d'administration : SC
Date de la première AMM : FDA avril 2018/ EMA février 2018
Laboratoires : KRN23; Kyowa Hakko Kirin Co. Ltd, Ultragenyx Pharmaceutical Inc.
Indications : Hypophosphatémie liée à l'X avec signes radiographiques d'atteinte osseuse chez les enfants âgés d'un an et plus et les adolescents en phase de croissance osseuse
Nécessité de
la réalisation des deux premières injections en milieu hospitalier,
des décisions d'instauration et d'arrêt de traitement prises après proposition documentée issue de réunion de concertation pluridisciplinaire au sein des centres de référence et de compétence des maladies rares du métabolisme du calcium et du phosphore, ainsi que des maladies rénales rares.
Prix indicatif : 7212 euros par flacon
Usage : Prescription initiale hospitalière. Elle est réservée aux spécialistes en pédiatrie, endocrinologie, diabète et nutrition, néphrologie, rhumatologie, médecine interne, oncologie ou aux médecins compétents en cancérologie.
Posologies : La dose initiale recommandée est de 0,4 mg/kg de poids corporel et la dose d'entretien habituelle est de 0,8 mg/kg de burosumab administrée toutes les deux semaines. La dose maximale est de 90 mg
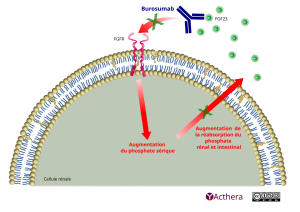
Mécanisme d'action :
Burosumab se lie et inhibe le facteur de croissance des fibroblastes 23 (FGF23) et ainsi augmente la réabsorption tubulaire du phosphate dans le rein et augmente le taux sérique de 1,25-dihydroxy-vitamine D.
Ce faisant, il améliore directement la résorption du phosphate (Pi) par le rein. De plus, grâce à ses effets sur le métabolisme de la vitamine D, il améliore indirectement la réabsorption du Pi par l'intestin. L'augmentation résultante du Pi sérique favorise l'amélioration de la qualité osseuse et de la minéralisation.
Vidéo présantant le mécanisme d'action (anglais)
Effets indésirables les plus fréquents: Réactions au site d’injection (57 %), céphalées (54 %), extrémités douloureuses (42 %), vitamine D diminuée (28 %), rash (23 %), douleur dentaire (19 %), abcès dentaire (14 %), myalgies (14 %) et sensations vertigineuses (11 %).
Contre-indications : Hypersensibilité à la substance active, administration concomitante de phosphate oral, d’analogues de la vitamine D, Phosphatémie à jeun supérieure aux valeurs normales pour l'âge en raison du risque d’hyperphosphatémie, Insuffisance rénale sévère ou insuffisance rénale terminale
Principales références :
- Résumé des caractéristiques produit (EMA) [pdf]
- Lien vers Human medicine European public assessment report (EPAR)
- Avis de la HAS sur Crysvita
- FDA
- Base de donnée publique des médicaments
- ANSM
- Centre de référence sur les agents tératogènes (CRAT) - pas de donnée au 12 juin 2024
- Vidal
- IMGT/DB
- HeTop
Remarque :
Dernière mise à jour : Juin 2024
Par : Mathilde Glaziou