Blinatumomab (BLINCYTO®)
Structure : Deux fragments scFv (VH-Vkappa) de souris reliés par un linker entre les 2 domaines VH
Code ATC: L01XC19
Mode de production : produit à partir de cellules ovariennes de hamster chinois (CHO) par la technique de l’ADN recombinant
Forme galénique : Flacon de poudre contient 38,5 µg de blinatumomab à reconstituer avec de l’eau pour préparations injectables pour aboutir à une concentration finale de de 12,5 µg/mL
Mode d'administration : IV
Date de la première AMM : FDA décembre 2014 / EMA novembre 2015
Laboratoires : Amgen Europe B.V.
Indications : Traitement des patients adultes présentant une leucémie aiguë lymphoblastique (LAL) à précurseurs B avec chromosome Philadelphie négatif en rechute ou réfractaire
Prix indicatif : XXX
Usage : Médicament réservé à l'usage hospitalier ; Prescription réservée aux spécialistes en hématologie ou aux médecins compétents en maladies du sang
Posologies : Pour LAL à précurseurs B avec chromosome Philadelphie négatif en rechute ou réfractaire, les patients peuvent recevoir 2 cycles de traitement. Un cycle de traitement est constitué de 28 jours (4 semaines) de perfusion continue. Chaque cycle de traitement est séparé par une période de repos sans traitement de 14 jours (2 semaines)
Poids du patient supérieur ou égal à 45 kg (dose fixe) :
cycle 1 jour 1 à 7 : 9 micro-grammes/jour en perfusion continue
cycle 1 jour 8 à 28 : 28 micro-grammes/jour en perfusion continue
cycle ultérieur jour 1 à 28 : 28 micro-grammes/jour en perfusion continue
Poids du patient inférieur à 45 kg (dose fixe) :
cycle 1 jour 1 à 7 : 5 micro-grammes/jour en perfusion continue
cycle 1 jour 8 à 28 : 15 micro-grammes/jour en perfusion continue
cycle ultérieur jour 1 à 28 : 15 micro-grammes/jour en perfusion continue
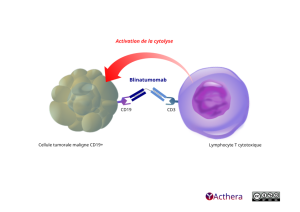
Mécanisme d'action :
Le blinatumomab est un anticorps bispécifique engageant les lymphocytes T (Bi-specific T cell engager) qui se lie sélectivement au CD19 exprimé à la surface des cellules de lignée B et au CD3 exprimé à la surface des lymphocytes T. Il active les lymphocytes T endogènes en liant le CD3 dans le complexe TCR (T-cell receptor) et le CD19 présent sur les cellules B saines et malignes. L'activité antitumorale de l'immunothérapie par le blinatumomab ne dépend pas des lymphocytes T portant un TCR spécifique ou des peptides antigéniques présentés par les cellules cancéreuses, mais est de nature polyclonale et indépendante des molécules HLA (human leukocyte antigen) présentes sur les cellules cibles. Le blinatumomab induit la formation d'une synapse cytolytique entre le lymphocyte T et la cellule tumorale libérant des enzymes protéolytiques pour tuer les cellules cibles en prolifération et quiescentes. Le blinatumomab est associé à une régulation positive transitoire des molécules d'adhérence cellulaire, la synthèse de protéines cytolytiques, le relargage de cytokines inflammatoires et la prolifération des lymphocytes T, et entraîne l'élimination des cellules CD19+
Effets indésirables les plus fréquents : fièvre (70,8 %), infections à pathogène non précisé (41,4 %), réactions liées à la perfusion (33,4 %), céphalées (32,7 %), nausées (23,9 %), anémie (23,3 %), thrombopénie (21,6 %), œdème (21,4 %), neutropénie (20,8 %), neutropénie fébrile (20,4 %), diarrhée (19,7 %), vomissements (19,0 %), rash (18,0 %), enzymes hépatiques augmentées (17,2 %), toux (15,0 %), infections bactériennes (14,1 %), tremblements (14,1 %), syndrome de relargage de cytokines (13,8 %), leucopénie (13,8 %), constipation (13,5 %), immunoglobulines diminuées (13,4 %), infections virales (13,3 %), hypotension (13,0 %), douleurs dorsales (12,5 %), frissons (11,7 %), douleurs abdominales (10,6 %), tachycardie (10,6 %), insomnie (10,4 %), douleurs dans les extrémités (10,1 %) et infections fongiques (9,6 %)
Contre-indications : Hypersensibilité à la substance active ou à l’un des excipients ; Allaitement
Principales références :
- Locatelli F, Zugmaier G, Rizzari C, Morris JD, Gruhn B, Klingebiel T, Parasole R, Linderkamp C, Flotho C, Petit A, Micalizzi C, Mergen N, Mohammad A, Kormany WN, Eckert C, Möricke A, Sartor M, Hrusak O, Peters C, Saha V, Vinti L, von Stackelberg A. Effect of Blinatumomab vs Chemotherapy on Event-Free Survival Among Children With High-risk First-Relapse B-Cell Acute Lymphoblastic Leukemia: A Randomized Clinical Trial. JAMA. 2021 Mar 2;325(9):843-854. doi: 10.1001/jama.2021.0987. PMID: 33651091; PMCID: PMC7926287.
- Foà R, Bassan R, Vitale A, Elia L, Piciocchi A, Puzzolo MC, Canichella M, Viero P, Ferrara F, Lunghi M, Fabbiano F, Bonifacio M, Fracchiolla N, Di Bartolomeo P, Mancino A, De Propris MS, Vignetti M, Guarini A, Rambaldi A, Chiaretti S; GIMEMA Investigators. Dasatinib-Blinatumomab for Ph-Positive Acute Lymphoblastic Leukemia in Adults. N Engl J Med. 2020 Oct 22;383(17):1613-1623. doi: 10.1056/NEJMoa2016272. PMID: 33085860.
- Kantarjian H, Stein A, Gökbuget N, Fielding AK, Schuh AC, Ribera JM, Wei A, Dombret H, Foà R, Bassan R, Arslan Ö, Sanz MA, Bergeron J, Demirkan F, Lech-Maranda E, Rambaldi A, Thomas X, Horst HA, Brüggemann M, Klapper W, Wood BL, Fleishman A, Nagorsen D, Holland C, Zimmerman Z, Topp MS. Blinatumomab versus Chemotherapy for Advanced Acute Lymphoblastic Leukemia. N Engl J Med. 2017 Mar 2;376(9):836-847. doi: 10.1056/NEJMoa1609783. PMID: 28249141; PMCID: PMC5881572.
- Nagorsen D, Kufer P, Baeuerle PA, Bargou R. Blinatumomab: a historical perspective. Pharmacol Ther. 2012 Dec;136(3):334-42. doi: 10.1016/j.pharmthera.2012.07.013. Epub 2012 Aug 24. PMID: 22940266.
- Goebeler ME, Bargou R. Blinatumomab: a CD19/CD3 bispecific T cell engager (BiTE) with unique anti-tumor efficacy. Leuk Lymphoma. 2016 May;57(5):1021-32. doi: 10.3109/10428194.2016.1161185. Epub 2016 Apr 6. PMID: 27050240.
Liens :
- Human medicine European public assessment report (EPAR)
- Avis de la HAS sur Blincyto
- Base de données publique des médicaments
- ANSM
- Meddispar (pas disponible au 31 mai 2022)
- Centre de référence sur les agents tératogènes (CRAT) (pas disponible au 31 mai 2022)
Remarque :
Dernière mise à jour : 31 mai 2022
Relecture par : Pr C. Carnoy