Bimekizumab (BIMZELX®)
Structure : AcM IgG1/kappa humanisé
Code ATC : L04AC21
Nomenclature Ge : IgG1κ G1e0
Cible: IL-17A, IL-17F et IL-17AF
Mode de production : Produit dans une lignée cellulaire d’ovaire de hamster chinois (CHO) génétiquement modifiée par technologie d’ADN recombinant
Forme galénique : 160 mg solution injectable en seringue préremplie ou en stylo prérempli
Mode d'administration : SC
Date de la première AMM : FDA 2023 / EMA Aout 2021
Laboratoires et lien vers xxx : UCB Pharma S.A.
Indications : Traitement du psoriasis en plaques modéré à sévère chez l’adulte qui nécessite un traitement systémique
Prix indicatif (année) : XXX
Usage : xxx
Posologies :
La dose recommandée pour les patients adultes atteints de psoriasis en plaques est de 320 mg (administrée sous forme de 2 injections sous-cutanées de 160 mg chacune) aux semaines 0, 4, 8, 12, 16 et toutes les 8 semaines par la suite. L’arrêt du traitement devra être envisagé chez les patients ne présentant aucune amélioration après 16 semaines de traitement.
Mécanisme d'action :
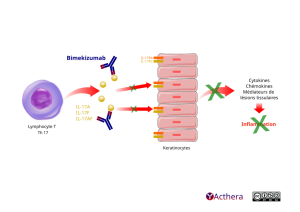
Le bimekizumab se lie de manière sélective aux cytokines IL-17A, IL-17F et IL-17AF avec une affinité élevée, bloquant leur interaction avec le complexe récepteur IL-17RA/IL-17RC. Des concentrations élevées d’IL-17A et d’IL-17F ont été impliquées dans la pathogenèse de plusieurs maladies inflammatoires à médiation immunitaire, dont le psoriasis en plaques. Le bimekizumab inhibe ces cytokines pro-inflammatoires, ce qui entraîne la normalisation de l’inflammation cutanée et par conséquent une amélioration des symptômes cliniques associés au psoriasis. À partir de modèles in vitro, il a été démontré que le bimekizumab inhibe l’expression du gène lié au psoriasis et la production de cytokines dans une plus grande mesure que l’inhibition de l’IL-17A seule.
Effets indésirables les plus fréquents : Les réactions indésirables les plus fréquemment rapportées étaient les infections des voies respiratoires supérieures (14,5 %) (le plus fréquemment, rhinopharyngite) et la candidose buccale (7,3 %) (se référer au RCP pour avoir la liste complète des effets indésirables).
Contre-indications : Hypersensibilité à la substance active ou à l’un des excipients ; Infections actives cliniquement importantes (par exemple : tuberculose active)
Principales références :
- Reich K, Warren RB, Lebwohl M, Gooderham M, Strober B, Langley RG, Paul C, De Cuyper D, Vanvoorden V, Madden C, Cioffi C, Peterson L, Blauvelt A. Bimekizumab versus Secukinumab in Plaque Psoriasis. N Engl J Med. 2021 Jul 8;385(2):142-152. doi: 10.1056/NEJMoa2102383. Epub 2021 Apr 23. PMID: 33891380.
- Warren RB, Blauvelt A, Bagel J, Papp KA, Yamauchi P, Armstrong A, Langley RG, Vanvoorden V, De Cuyper D, Cioffi C, Peterson L, Cross N, Reich K. Bimekizumab versus Adalimumab in Plaque Psoriasis. N Engl J Med. 2021 Jul 8;385(2):130-141. doi: 10.1056/NEJMoa2102388. Epub 2021 Apr 23. PMID: 33891379.
- Reich K, Papp KA, Blauvelt A, Langley RG, Armstrong A, Warren RB, Gordon KB, Merola JF, Okubo Y, Madden C, Wang M, Cioffi C, Vanvoorden V, Lebwohl M. Bimekizumab versus ustekinumab for the treatment of moderate to severe plaque psoriasis (BE VIVID): efficacy and safety from a 52-week, multicentre, double-blind, active comparator and placebo controlled phase 3 trial. Lancet. 2021 Feb 6;397(10273):487-498. doi: 10.1016/S0140-6736(21)00125-2. Erratum in: Lancet. 2021 Feb 20;397(10275):670. PMID: 33549193.
- Adams R, Maroof A, Baker T, Lawson ADG, Oliver R, Paveley R, Rapecki S, Shaw S, Vajjah P, West S, Griffiths M. Bimekizumab, a Novel Humanized IgG1 Antibody That Neutralizes Both IL-17A and IL-17F. Front Immunol. 2020 Aug 21;11:1894. doi: 10.3389/fimmu.2020.01894. PMID: 32973785; PMCID: PMC7473305.
Liens :
- Human medicine European public assessment report (EPAR)
- HAS
- Base de données publique des médicaments (pas disponible au 30 mai 2022)
- ANSM
- Meddispar (pas disponible au 30 mai 2022)
- Centre de référence sur les agents tératogènes (CRAT) (pas disponible au 30 mai 2022)
Remarque :
Dernière mise à jour : 30 mai 2022
Relecture par : Pr C. Carnoy