Basiliximab (SIMULECT®)
Type : AcM chimérique, IgG1k
Code ATC : L04AC02
Nomenclature Ge : IgG1λ G1e0
Cible: CD25, sous unité α du récepteur à l'interleukine 2
Mode d'administration : IV
Forme galénique : Poudre (blanche) et solvant pour solution injectable ou pour perfusion à 10 mg et à 20 mg : Poudre à 10 mg à reconstituer avec 2,5 ml de solvant ; Poudre à 20 mg à reconstituer avec 5 ml de solvant.
Date de la première AMM : FDA 1998 / EMA 1998
Laboratoires : Novartis Pharmaceuticals Corp
Indications : Prévention du rejet aigu de greffe après transplantation rénale allogénique
Prix indicatif :
Usage : réservé à l'usage hospitalier
Posologies : pour les adultes, 20 mg administrés dans les 2h qui précèdent la transplantation, puis 20 mg 4 jours après la transplantation
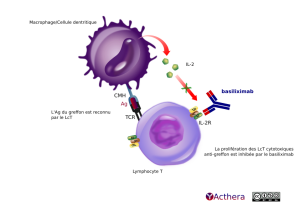
Mécanisme d'action :
Lors de la reconnaissance du greffon par l'hôte une importante production de l'IL-2 est observée. L'IL-2 provoque une prolifération des LT cytotoxiques, et une sécrétion d'IL-3, d'IL-4 et d'IFNγ provoquant une inflammation, causant le rejet. Le basiliximab se fixe sur la chaîne α du récepteur à l'IL-2 (CD25) qui n'est exprimé que sur les cellules activées, et bloque ainsi la fixation de l'IL-2 à son récepteur. Le basiliximab est donc utilisé en prévention du rejet aigu. Il inhibe l'activité des récepteurs à IL-2 pendant 4 à 6 semaines et est non-lymphopéniant. Le daclizumab (ZENAPAX©) qui a la même cible que le basiliximab n'est plus commercialisé en Europe depuis janvier 2009
Effets indésirables les plus fréquents: constipation, infection urinaire, hypertension
Contre-indications : hypersensibilité au médicament, grossesse et allaitement
Principales références :
- Alvarez Castro et al., 2012 ; McKeage and McCormack, 2010
- Lien vers Human medicine European public assessment report (EPAR)
Liens :
- Lien vers Human medicine European public assessment report (EPAR)
- - Avis de la
- Base de données publique des médicaments
- ANSM
- IMGT/mAb-DB
Remarque :
Dernière mise à jour :
Relecture par : Pr C. Carnoy