Alemtuzumab (LEMTRADA®)
Aussi connu sous le nom de Campath® (ou Mabcampath® aux USA)
Type : AcM humanisé, IgG1k
Cible: CD52
Mode d'administration : IV
Date d'AMM : FDA 2001 / EMA 2013
Laboratoires : Genzyme Therapeutics
Indications : patients adultes atteints d'une forme active de sclérose en plaques rémittente (SEP-RR)
Etudes cliniques : CAMMS323 et CAMMS324 (Phase III)
Prix indicatif :
Usage : réservé à l'usage hospitalier
Posologies : 12 mg par jour pendant 5 jours puis 12 mois plus tard, 12 mg par jour pendant 3 jours
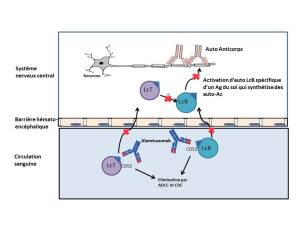
Mécanisme d'action :
L'alemtuzumab est un anticorps monoclonal humanisé anciennement utilisé dans la leucémie lymphoïde chronique sous le nom de Mabcampath®. Il a été retiré du marché par la filiale de Sanofi, Genzyme, pour des raisons commerciales. Le mécanisme d'action de l'alemtuzumab dans la sclérose en plaque n'est pas clairement élucidé mais l'anticorps a démontré, in vitro, sa capacité à exercer de l'ADCC et de la cytotoxicité du complément ce qui provoque une déplétion lymphocytaire périphérique. Une modification du nombre de lymphocytes T régulateurs, T et B mémoires a également été observée. Cette déplétion permettrait de réduire le risque des poussées.
Effets indésirables les plus fréquents: infections fongiques, troubles thyroïdiens, neutropénie, leucopénie, thrombopénie, infections des voies respiratoires
Contre-indications : hypersensibilité au médicament, infection par le VIH
Principales références :
- Jones and Goldman, 2014), (Menge et al., 2014), (Hu et al., 2009)
- Avis de la HAS sur Lemtrada
- Lien vers Human medicine European public assessment report (EPAR)