Aflibercept (Baiama®)
Attention :
Fiche en cours de rédaction
Structure : Protéine de fusion recombinante composée des fragments des domaines extracellulaires des récepteurs de type 1 et 2 du VEGF humain fusionnés au fragment Fc de l’IgG1 humaine.
Code ATC : S01LA05
Nomenclature Ge : xxx
Mode de production : Produit dans des cellules ovariennes K1 de hamster chinois (CHO) par la technologie de l’ADN recombinant.
Forme galénique : Solution injectable
Mode d'administration : Intravitréenne
Date de la première AMM : FDA xxx / EMA Janvier 2025
Laboratoire : Formycon AG
Indications :
Baiama est indiqué chez l’adulte dans le traitement de la :
Forme néovasculaire (humide) de la dégénérescence maculaire liée à l’âge (DMLA)
Baisse d’acuité visuelle due à l’œdème maculaire secondaire à une occlusion de branche veineuse rétinienne (OBVR) ou de la veine centrale de la rétine (OVCR)
Baisse d’acuité visuelle due à l’œdème maculaire diabétique (OMD)
Baisse d’acuité visuelle due à une néovascularisation choroïdienne (NVC) myopique
Prix indicatif (année) : XXX
Posologies :
Forme humide de la DMLA :
La dose recommandée est de 2 mg, correspondant à 0,05 mL.
A l’instauration du traitement, Baiama est injecté une fois par mois pendant 3 mois consécutifs. L’intervalle entre deux injections est ensuite étendu à deux mois. En fonction du jugement du médecin sur les résultats visuels et/ou anatomiques, l’intervalle entre deux injections peut être maintenu à deux mois ou davantage étendu au cours duquel les intervalles entre les injections augmentent par ajustements de 2 ou 4 semaines afin de maintenir la réponse visuelle et/ou anatomique.
En cas de détérioration des paramètres visuels et/ou anatomiques, l’intervalle entre deux injections doit être réduit en conséquence.
Œdème maculaire secondaire à une occlusion veineuse rétinienne (OVCR ou OBVR) :
La dose recommandée est de 2 mg, correspondant à 0,05 mL.
Le traitement est administré mensuellement. L’intervalle entre deux injections ne doit pas être inférieur à un mois. Si les paramètres visuels et anatomiques indiquent que la poursuite du traitement n’apporte pas de bénéfice au patient, le traitement par Baiama doit être arrêté. Trois injections mensuelles ou plus peuvent être nécessaires. Ensuite, le traitement peut être poursuivi avec une augmentation progressive de l’intervalle entre deux injections afin de maintenir la réponse visuelle et/ou anatomique.
Œdème maculaire diabétique :
La dose recommandée est de 2 mg, correspondant à 0,05 mL.
A l’instauration du traitement, Baiama est injecté une fois par mois pendant 5 mois consécutifs suivi d’une injection tous les 2 mois. En fonction du jugement du médecin sur les résultats visuels et/ou anatomiques, l’intervalle entre deux injections peut être maintenu à 2 mois ou individualisé au cours duquel les intervalles entre les injections augmentent généralement par ajustement de 2 semaines afin de maintenir la réponse visuelle et/ou anatomique.
Néovascularisation choroïdienne myopique :
La dose recommandée est d’une injection intravitréenne unique de 2 mg , correspondant à 0,05 mL.
Des injections supplémentaires peuvent être administrées si les paramètres visuels et/ou anatomiques indiquent que la maladie persiste. Les récidives doivent être traitées comme des nouvelles manifestations de la maladie. Le calendrier de suivi doit être déterminé par le médecin qui administre le traitement. L’intervalle entre deux injections ne doit pas être inférieur à un mois.
Mécanisme d'action :
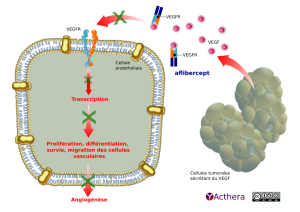
L’aflibercept agit comme un leurre soluble de récepteur, qui se lie au VEGF-A et au PlGF avec une affinité supérieure à celle de leurs récepteurs naturels et peut ainsi inhiber la liaison et l’activation de ces récepteurs apparentés.
Effets indésirables les plus fréquents :
Les effets indésirables les plus fréquemment observés étaient l’hémorragie conjonctivale, hémorragie rétinienne, la baisse de l’acuité visuelle, la douleur oculaire , la cataracte , l’augmentation de la pression intraoculaire, le décollement du vitré et les corps flottants vitréens. (se référer au RCP pour avoir la liste complète des effets indésirables)
Contre-indications :
Hypersensibilité à la substance active ou à l’un des excipients
Infection oculaire ou périoculaire active ou suspectée.
Inflammation intraoculaire sévère active.
Principales références :
-
-
-
-
Liens :
- Human medicine European public assessment report (EPAR)
- HAS
- Base de données publique des médicaments
- ANSM
- Meddispar
- Vidal
- Centre de référence sur les agents tératogènes (CRAT)
- IMGT/mAb-DB
- Vidéos d'aide à l'administration du .... en stylo et en seringue (français)
Remarque :
Création de la fiche : Pr C. Carnoy
Dernière mise à jour :
Relecture par :