Eculizumab (EPYSQLI®) - Biosimilaire
Attention :
Fiche en cours de rédaction
Autre nom : xxx
Structure : AcM humanisé IgG2/4 avec CH2 et CH3 humaines d'une IgG4 + CH1 et région charnière humaine d'une IgG2
Code ATC : L04AJ01
Nomenclature Ge : IgG2/4κ G4e2
Cible: fragment du complément C5
Mode de production : L'éculizumab est un Ac monoclonal humanisé (IgG2/4κ) produit dans la lignée cellulaire NS0 par la technologie de l'ADN recombinant
Forme galénique : 300 mg de solution à diluer pour perfusion (30 mL)
Mode d'administration : IV
Date de la première AMM : FDA XXX / EMA mai 2023
Laboratoires : Samsung Bioepis
Indications : Epysqli est indiqué chez l'adulte et l'enfant pour le traitement de :
La preuve d'un bénéfice clinique est démontrée chez les patients présentant une hémolyse avec un ou plusieurs symptômes cliniques indiquant une activité élevée de la maladie, indépendamment des antécédents transfusionnels.
Myasthénie généralisée réfractaire (MGG) chez les patients présentant des anticorps anti-récepteurs de l'acétylcholine (AChR) positifs.
Trouble du spectre de la neuromyélite optique (NMOSD) chez les patients porteurs d'anticorps anti-aquaporine-4 (AQP4) avec une évolution récurrente de la maladie.
Prix indicatif (année) : XXX
Usage : Epysqli doit être administré par un professionnel de santé et sous surveillance d’un médecin ayant l’expérience de la prise en charge des patients atteints de troubles hématologiques ou rénaux.
Posologies :
- Le schéma posologique de la PNH pour les patients adultes (≥18 ans) consiste en une phase initiale de 4 semaines suivie d'une phase d'entretien :
Phase initiale : 600 mg de Eculizumab administrés en IV de 25 à 45 minutes (35 minutes ± 10 minutes) chaque semaine pendant les 4 premières semaines.
Phase d'entretien : 900 mg de Eculizumab administrés en IV de 25 à 45 minutes (35 minutes ± 10 minutes) pendant la cinquième semaine puis toutes les 2 semaines +/- 2 jours.
- Le schéma posologique du SHU atypique, de la GMO réfractaire et de la NMOSD pour les patients adultes (≥18 ans) comprend une phase initiale de 4 semaines suivie d'une phase d'entretien :
Phase initiale : 900 mg de Eculizumab administrés par perfusion intraveineuse de 25 à 45 minutes (35 minutes ± 10 minutes) chaque semaine pendant les 4 premières semaines.
Phase d'entretien : 1 200 mg de Eculizumab administrés par perfusion intraveineuse de 25 à 45 minutes (35 minutes ± 10 minutes) pendant la cinquième semaine, puis toutes les 2 semaines +/- 2 jours
- Les patients pédiatriques atteints de PNH et de SHUA dont le poids corporel est ≥ 40 kg sont traités avec les recommandations de dosage pour adultes. En dessous de 40kg, la dose se calcule en fonction du poids.
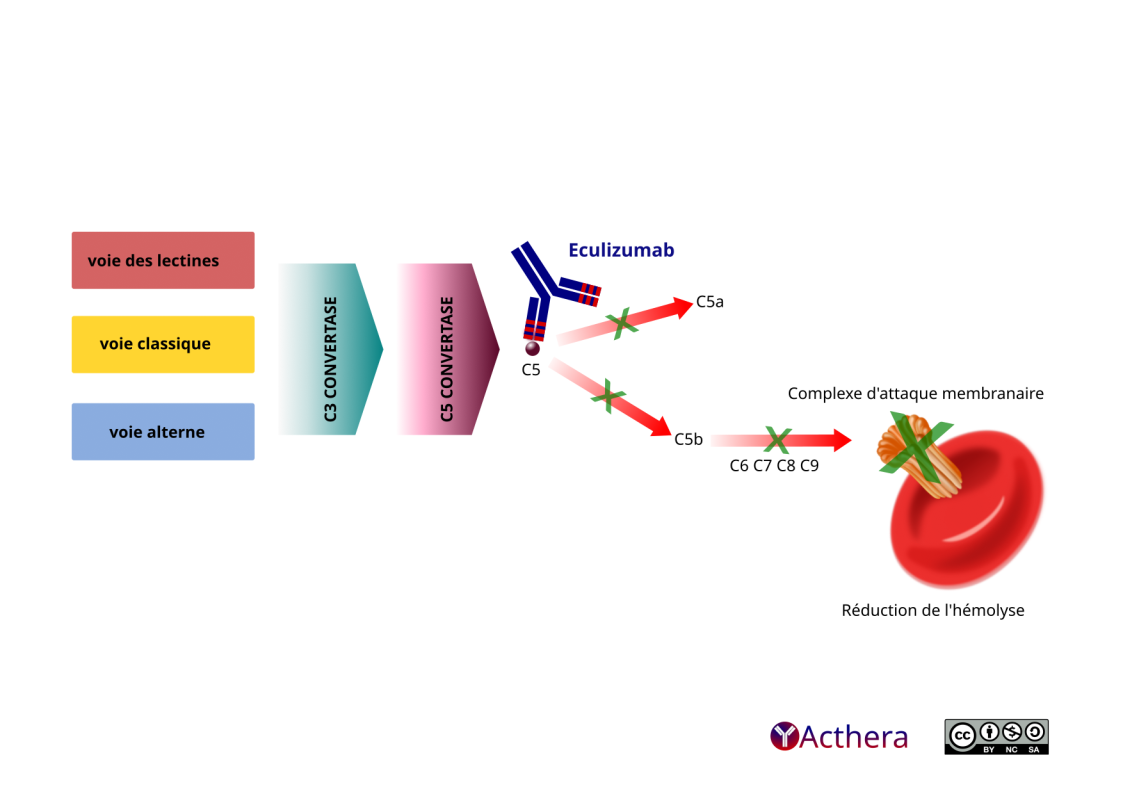
Mécanisme d'action :
L'eculizumab est un inhibiteur de la voie terminale du complément qui se lie de manière spécifique à la protéine C5 du complément avec une affinité élevée, inhibant ainsi son clivage en C5a et C5b par la C5 convertase et empêchant la formation du complexe d'attaque membranaire composé de C5b, C6, C7, C8, C9. Ainsi l'hémolyse induite par l'amplification du système du complément reste limitée.
Effets indésirables les plus fréquents : céphalées, infections (risque augmenté d'infection par Neisseria meningitidis)
Contre-indications : Patients présentant une infection par Neisseria meningitidis ou qui ne sont actuellement pas vaccinés contre Neisseria meningitidis, à moins qu'ils ne reçoivent un traitement prophylactique avec des antibiotiques appropriés jusqu'à 2 semaines après la vaccination, ou hypersensibilité au médicament.
Principales références :
-
-
-
-
Liens :
- Human medicine European public assessment report (EPAR)
- HAS
- Base de données publique des médicaments
- ANSM
- Meddispar
- Vidal
- Centre de référence sur les agents tératogènes (CRAT)
Remarque :
Création de la fiche :
Dernière mise à jour :
Relecture par :